1、填空题 把18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫酸100ml,实验操作如下,
1、将配好的稀硫酸倒入试剂瓶中,贴好标签;
2、盖好容量瓶塞,反复颠倒摇匀;
3、用量筒量取___________ml的18.0mol·L-1的浓硫酸;
4、将___________沿烧杯内壁慢慢注入盛有少量___________的烧杯中;
5、用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
6、将已冷却至室温的硫酸溶液沿玻璃棒注入___________;
7、改用胶头滴管逐滴加蒸馏水,至____________________________;
8、继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处;
(1)将上述步骤按正确的顺序排列_____________________
(2)填写上述步骤中的有关空格。
参考答案:(1)3、4、6、5、7、8、2、1
(2)11.1;浓硫酸;蒸馏水;100mL容量瓶;凹液面与刻度线相切
本题解析:
本题难度:一般
2、填空题 某无色溶液中只可能含有NH4+、K+、Al3+、Fe3+、Cl-、SO42-等离子中的几种离子。
①该溶液的焰色反应呈现出紫色。
②取10 mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03 mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。
③另取10 mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解。并且随NaOH溶液的加入,沉淀和气体的变化关系如下图所示。
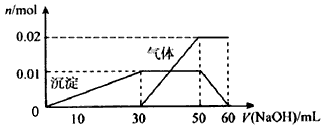
(1)该溶液中一定含有____________(填离子的化学式)离子,一定不含有的离子有___________(填离子的化学式)。
(2)①根据图中所示数据,计算实验中使用的NaOH溶液的物质的量浓度为______________
②在配制实验所需100 mL NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要__________
(填仪器名称)。
(3)根据图示信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为______________
参考答案:(1)K+、NH4+、Al3+、SO42-;Cl-、Fe3+
(2)①1 mol/L;②100 mL容量瓶、胶头滴管
(3)1 mol/L
本题解析:
本题难度:困难
3、选择题 实验室里需要480mL0.100mol?L-1的CuSO4溶液,以下配制操作正确的是( )
A.称取7.68gCuSO4,加入500mL水
B.称取12.0g胆矾,配成500mL溶液
C.称取8.0gCuSO4,配成500mL溶液
D.称取8.0g胆矾,配成500mL溶液
参考答案:需要480mL溶液,实际只能配置500ml,配制500mL0.100mol?L-1的CuSO4溶液,溶质的物质的量为:n=c×V=0.5L×0.100mol/L=0.0500mol,需要溶质的质量为:m(CuSO4)=0.05mol×160g/mol=8.0g,
或m(CuSO4?5H20)=0.05mol×250g/mol=12.5g.
A.应称取8.0gCuSO4,配成500mL溶液,水的体积不等于溶液的体积,故A错误;
B.称取12.5g胆矾,配成500mL溶液,故B正确;
C.称取8.0gCuSO4,配成500mL溶液,溶液的浓度为0.100mol?L-1,故C正确;
D.称取12.5g胆矾,配成500mL溶液,故D错误.
故选BC.
本题解析:
本题难度:一般
4、选择题 要配制浓度约为2mol/L,NaOH溶液100ml,下面的操作正确的是( )
A.称取8gNaOH固体,放入250ml烧杯中,用100ml量筒量取100ml蒸馏水,加入8gNaOH固体,同时不断搅拌至固体溶解
B.称取8gNaOH固体,放入100ml量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100ml
C.称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入蒸馏水到刻度,盖好瓶塞,反复摇匀
D.称取8gNaOH固体,放入烧杯中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解且冷却至室温后,移入100mL容量瓶中,再加入蒸馏水到刻度,盖好瓶塞,反复摇匀
参考答案:D
本题解析:
本题难度:一般
5、简答题 实验室配制500ml2mol?L-1的H2SO4溶液
(1)所需仪器应该有容量瓶、玻璃棒、量筒、______、______.
(2)容量瓶在使用前,首先应检查______.
(3)此实验中,玻璃棒的两个作用分别是______、______.
(4)配制时,要用量筒量取密度为1.84g/cm3,质量分数为98%的浓硫酸______ml.
(5)若配好摇匀后,发现容量瓶中的液面略低于刻度线,问是否应该补充蒸馏水______(填“应该”或“不应该”);若所用的容量瓶中事先有少量的蒸馏水,则对实验结果有无影响______.(填“有影响”或“无影响”)
参考答案:(1)实验室配制500ml 2mol?L-1的H2SO4溶液,配制顺序是:计算→量取→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,需要的仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:胶头滴管; 烧杯.
(2)容量瓶有瓶塞,容量瓶在使用前,首先应检查容量瓶是否漏水,
故答案为:检验容量瓶是否漏水;
(3)在稀释浓硫酸时,使用玻璃棒进行搅拌,加速溶解过程;在转移溶液时,使用玻璃棒进行引流,避免液体流到容量瓶以外,
故答案为:搅拌; 引流;
(4)密度为1.84g/cm3,质量分数为98%的浓硫酸浓度为:1000×1.84×98%98mol/L=18.4mol/L,
500ml 2mol?L-1的H2SO4溶液中需要硫酸的物质的量为:2mol?L-1×0.5L=1mol,需要浓硫酸的体积为:1mol18.4mol/L=0.0543L=54.3mL,
故答案为:54.3ml;
(5)配好摇匀后,发现容量瓶中的液面略低于刻度线,由于刻度线上面含有部分溶液没有流下来,不需要加入蒸馏水;若配制前容量瓶中有蒸馏水,由于定容时需要加入蒸馏水,所以不影响配制结果,
故答案为:不应该; 无影响.
本题解析:
本题难度:一般