1、选择题 下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是?
A.Cu(OH)2和盐酸;Cu(OH)2和CH3COOH
B.BaCl2和NaHSO4;Ba(OH)2和Na2SO4
C.NaHCO3和NaHSO4;Na2CO3和NaHSO4
D.NaHCO3(过量)和Ca(OH)2;Ca(HCO3)2和NaOH(过量
参考答案:BD
本题解析:略
本题难度:简单
2、选择题 下列离子方程式书写正确的是( )
A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.向NaAlO2溶液中加盐酸至溶液呈酸性:A1O2-+4H+=Al3++2H2O
C.向碳酸氢铵溶液中加入过量的NaOH溶液:HCO3-+OH-=CO32-+H2O
D.Cl2与H2O反应:Cl2+H2O=2H++Cl-+C1O-
参考答案:A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液的离子反应为Ca2++HCO3-+OH-=CaCO3↓+H2O,故A错误;
B.向NaAlO2溶液中加盐酸至溶液呈酸性的离子反应为A1O2-+4H+=Al3++2H2O,故B正确;
C.向碳酸氢铵溶液中加入过量的NaOH溶液:NH4++HCO3-+2OH-=CO32-+H2O+NH3.H2O,故C错误;
D.Cl2与H2O反应的离子反应为Cl2+H2O=H++Cl-+HC1O,故D错误;
故选B.
本题解析:
本题难度:一般
3、填空题 X、Y、Z三种物质有如图所示转化关系

(1)根据上述转化关系,写出下列物质的化学式:X?、Y?、
Z?试剂甲?,试剂乙?(每空1分)。
(2)写出上述各步反应①~⑤的离子方程式:
①?;②??;
③?;④ ?;
⑤?(每空2分)。
参考答案:X:? MgSO4? Y : Mg(OH)2? Z:? MgCl2
①? SO42- +Ba2+ =BaSO4↓
②? Mg2+ +2OH- = Mg(OH)2↓
③ Mg(OH)2 +2H+ = Mg2+ +2H2O
④ Ag+ + Cl- =AgCl↓
⑤ SO42- +Ba2+ =BaSO4↓(每答1分)
本题解析:略
本题难度:简单
4、选择题 下列说法正确的是( )
A.NaHCO3的电离方程式为:NaHCO3=Na++H++CO32-
B.金属氧化物不一定是碱性氧化物
C.在碱性溶液中能大量共存的离子为:Fe3+、Na+、Cl-、SO42-
D.SO3溶于水,其水溶液能导电,SO3是电解质
参考答案:A、碳酸氢钠电离生成碳酸氢根和钠离子,正确应为:NaHCO3═Na++HCO3-,故A错误;
B、过氧化钠不是碱性氧化物,故金属氧化物不一定是碱性氧化物,故B正确;
C、碱性溶液中Fe3+能够生成氢氧化铁沉淀,无法共存,故C错误;
D、SO3溶于水,其水溶液能导电,导电的是生成的硫酸电离的离子,不是三氧化硫电离的离子,故SO3不是电解质,故D错误;
故选B.
本题解析:
本题难度:简单
5、填空题 Ⅰ.铁盐、亚铁盐是实验室常用的药品。
请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为________________。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变血红色。继续滴加双氧水,血红色逐渐褪去,且有气泡产生。
写出上述变化中,有关反应的离子方程式:
①____________________________________;
②Fe3++3SCN-=Fe(SCN)3;
③11H2O2+2SCN-=2SO42—+2CO2↑+N2↑+10H2O+2H+
若生成1 mol N2,H2O2和SCN-的反应中转移电子的物质的量是________ mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为________。
Ⅱ.某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理。
(4)实验前:①先用0.1 mol·L-1 H2SO4洗涤Fe粉,其目的是__________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液通入________(写化学式)。
(5)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应生成的阳离子分别是________、________。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________________。
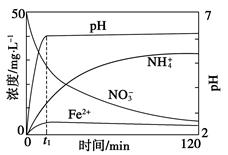
参考答案:Ⅰ.(1)2Fe3++2I-=2Fe2++I2
(2)2Fe2++H2O2+2H+=2Fe3++2H2O 22
(3)I->Fe2+>SCN-
Ⅱ.(4)除去Fe粉表面的铁锈(Fe2O3)等杂质 N2
(5)Fe2+、NH4+ 溶液的pH增大,Fe2+形成了Fe(OH)2(或与溶液中OH-结合)
本题解析:(1)Fe3+能氧化I-,离子方程式为2Fe3++2I-=2Fe2++I2。
(2)Fe2+和SCN-不反应,当加入H2O2时,发生2Fe2++2H++H2O2=2Fe3++2H2O,然后Fe3+和SCN-反应生成血红色溶液,继续滴加H2O2,SCN-被氧化。根据反应③,当有1 mol N2生成时,转移电子的物质的量为11×2×[-1-(-2)] mol=22 mol。(注:根据氧化剂计算方便)
(3)根据(1)(2)中方程式可得还原性I->Fe2+>SCN-。(根据还原剂还原性大于还原产物还原性)
(4)因为Fe粉表面有铁锈,所以应预先用H2SO4除去。因为Fe粉在溶液中能被O2氧化,所以应通入N2排除O2的干扰。
(5)根据图中信息,Fe粉被NO3—氧化成Fe2+,其本身被还原成NH4+,在此过程中碱性增强,因为有OH-生成,Fe2+与之反应生成Fe(OH)2沉淀,造成Fe2+的浓度变化不大。
本题难度:困难