1、选择题 下列说法错误的是
A.H2O2和Na2O2都属于氧化物,两种物质中所含的化学键类型完全相同
B.原子核外在离核较远区域的电子易失去,其原因是这些电子能量较高
C.第三周期非金属元素形成氢化物的稳定性从左到右逐渐增强
D.在周期表的金属元素和非金属元素的交界处寻找半导体,在过渡元素区中寻找催化剂
参考答案:A
本题解析:A、H2O2和Na2O2都属于氧化物,前者是共价化合物,含有共价键,后者是离子化合物,含有共价键和离子键,错误;
本题难度:一般
2、选择题 “铱星”计划中的铱的一种同位素是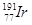 ,其核内中子数与质子数之差是 (? )
,其核内中子数与质子数之差是 (? )
A.77
B.114
C.191
D.37
参考答案:D
本题解析:在表示原子组成时,元素符号的左下角表示的是质子数,左上角是质量数。质子数和中子数之和是质量数,所以该核内中子数与质子数之差是191-77-77=37.答案是D。
本题难度:简单
3、选择题 下列各组元素性质递变的关系错误的是
A.Li、Be、B原子最外层电子数逐渐增多
B.Li,Na,K的金属性依次增强
C.P、S、C1最高正价依次升高
D.N、0、F氢化物的稳定性依次减弱
参考答案:D
本题解析:D项:N、0、F的非金属性依次增强,其氢化物的稳定性依次增强,故错。故选D。
点评:本题考查的是元素周期律的相关知识,题目难度不大,熟悉元素周期律的知识是解题的关键。
本题难度:一般
4、选择题 下列化学用语书写正确的是:
A.氯原子的结构示意图: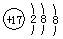
B.作为相对原子质量测定标准的碳核素为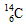
C.氯化镁的电子式: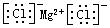
D.HClO的结构式为H-Cl-O
参考答案:C
本题解析:略
本题难度:简单
5、选择题 短周期元素X、Y、Z、W、Q在元素周期表中的位置如图所示。下列说法正确的是

A.元素W的最高价氧化物对应的水化物的酸性比Q的强
B.原子半径的大小顺序为:X>Y>Z>W>Q
C.离子Y2-和Z3+的核外电子数和电子层数都不相同
D.元素Y与元素W的最高化合价的数值等于其族序数
参考答案:A
本题解析:由元素所在周期表中的位置可知,X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素。A、同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强,故Q的最高价氧化物的水化物的酸性较强,A正确;B、原子核外电子层数越多,半径越大,同一周期元素原子半径从左到右逐渐减小,则有:rZ>rW>rQ>rX>rY,B错误;C、离子Y2-和Z3+的核外电子数都为10,离子核外有2个电子层,电子层数相同,C错误;D、氧元素一般没有正化合价,最高化合价不等于族序数,D错误;选A。
本题难度:一般