1、选择题 下列物质中既能与氢氧化钠溶液反应,又能与稀硫酸溶液反应的是(?)
①Al?②Al(OH)3?③Al2O3?④NaHCO 3?⑤苯?⑥乙炔?⑦醋酸
3?⑤苯?⑥乙炔?⑦醋酸
⑧乙酸乙酯?⑨蛋白质
A.①②③⑦⑧⑨
B.①②③④⑧⑨
C.②④③⑥⑦⑧⑨
D.全部
参考答案:B
本题解析:略
本题难度:简单
2、选择题 a g下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a 的选项有?
A.HCHO
B.CH3COOCH2CH3
C.HOOCCOOH
D.纤维素
参考答案:B D
本题解析:本题就是考察物质与过氧化钠反应的实质问题, 对于这样的题目必须清楚反应的本质所在,例如:a g氢气在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,这时过氧化钠增重的质量也是a g,原因是: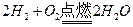 ,
,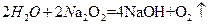 ,两个方程式叠加,就可以得到反应发生的本质
,两个方程式叠加,就可以得到反应发生的本质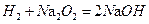 ,所以增重的质量就为氢气的质量,a g
,所以增重的质量就为氢气的质量,a g 氢气在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,这时过氧化钠增重的质量也是a g,原因:
氢气在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,这时过氧化钠增重的质量也是a g,原因: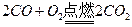 ,
,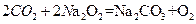 ,方程式叠加得到:
,方程式叠加得到: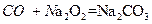 ,增重的质量就为
,增重的质量就为 的质量。所以对于本题出现的有机物中,当
的质量。所以对于本题出现的有机物中,当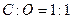 时,有机物就可以看成
时,有机物就可以看成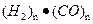 ,这时增重的质量就是有机物的质量(即:b=a);当
,这时增重的质量就是有机物的质量(即:b=a);当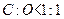 时,有机物就可以看成
时,有机物就可以看成 ,这时增重的质量就是有机物的质量减去部分氧元素的质量(即:b<a)
,这时增重的质量就是有机物的质量减去部分氧元素的质量(即:b<a) 当
当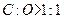 时,增重的质量就是有机物的质量加上得到的部分氧元素的质量(即:b>a).所以本题的关键就是找出有机物中
时,增重的质量就是有机物的质量加上得到的部分氧元素的质量(即:b>a).所以本题的关键就是找出有机物中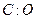 必须大于1:1。A项
必须大于1:1。A项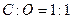 ,a=b;B项
,a=b;B项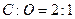 ,b>a,;C项
,b>a,;C项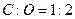 ,b<a?;D项
,b<a?;D项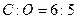 ,b>a。
,b>a。
本题难度:一般
3、填空题 (8分)碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠的化学式是_________,俗称_________,其水溶液显_________性(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_________。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成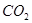 的量,前者_________后者(填“>”、“<”或“=”)
的量,前者_________后者(填“>”、“<”或“=”)
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为__________________________。
参考答案:(1)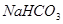 ?小苏打?碱
?小苏打?碱
(2)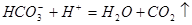
(3)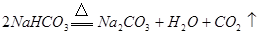
本题解析:(1)碳酸氢钠的化学式是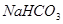 ,俗称小苏打,为强碱弱酸盐,其水溶液显碱性;
,俗称小苏打,为强碱弱酸盐,其水溶液显碱性;
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为
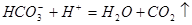
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为:
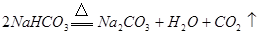
本题难度:一般
4、实验题 (9分)某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)请回答:
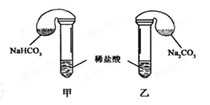
(1)(3分)各组反应开始时,______装置中的气球体积先变大,该装置中反应的离子方程式是??。
(2)(6分)当试管中不再有气体生成时,三组实验出现不同现象。请参照第①组,分析原因的方式填写下表的空格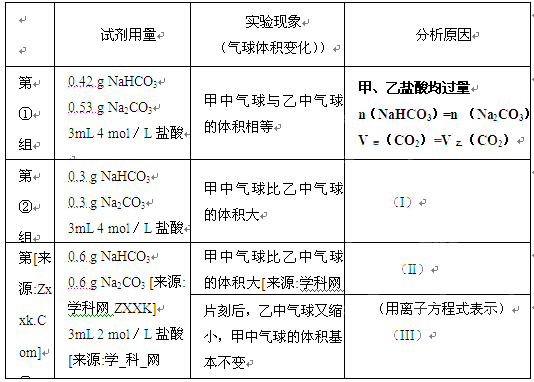
参考答案:(9分)
(1)(3分)_____甲____、___HCO3-+H+==H2O+ CO2↑________
(2)(6分)当试管中不再有气体生成时,三组实验出现不同现象。请参照第①组,分析原因的方式填写下表的空格
甲、乙盐酸均过量??n(NaHCO3)="n" (Na2CO3 ?V甲(CO2)=V乙(CO2)
(I)甲、乙盐酸均过量?n(NaHCO3)>n(Na2CO3)??V(CO2)甲>V(CO2)乙
(II)甲、乙盐酸均不足量,?消耗的n(NaHCO3)>n (Na2CO3)?V(CO2)甲>V(CO2)乙
(III)CO2+H2O+CO32-="2" HCO3-
本题解析:
方法:(1)根据生成二氧化碳的反应速率判断;
(2)清楚发生反应,根据过量计算判断CO2气体产生的量,分析现象的原因.
(I)先判断酸是否过量,再计算碳酸钠、碳酸氢钠的物质的量的关系,从而确定生成气体的关系;
(II)先判断酸是否过量,再计算碳酸钠、碳酸氢钠的物质的量的关系,从而确定生成气体的关系;
(III)根据溶液的成分及二氧化碳的性质分析.
解:(1)甲装置发生反应:HCO3-+H+═H2O+CO2↑;乙装置发生反应:CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,甲装置内反应速率较快,单位时间产生的CO2多,故甲装置中的气球体积先变大.
故答案为:甲;HCO3-+H+═H2O+CO2↑;
(2)(I)质量相同的碳酸氢钠和碳酸钠,碳酸氢钠的物质的量大于碳酸钠的物质的量,一个碳酸钠和碳酸氢钠分子中含有的碳原子个数相同,所以与过量的盐酸反应后,碳酸氢钠生成的二氧化碳多.
故答案为:甲、乙盐酸均过量,n(NaHCO3)>n(Na2CO3),V(CO2)甲>V(CO2)乙;
(II)盐酸的物质的量=6×10-3mol,n(NaHCO3)=0.6g/84g·mol-1=7.1×10-3mol,
n(Na2CO3)=0.6g/106g·mol-1=5.7×10-3mol,通过(1)方程式知,盐酸均不足量,与相同物质的量的盐酸反应,消耗的n(NaHCO3)>n (Na2CO3),生成的 V(CO2)甲>V(CO2)乙.
故答案为:甲、乙盐酸均不足量,消耗的n(NaHCO3)>n (Na2CO3)? V(CO2)甲>V(CO2)乙;
(III)该反应有剩余的碳酸钠,生成的二氧化碳又和碳酸钠反应生成碳酸氢钠,所以气体体积减少,乙中气球会缩小,反应的离子方程式为CO2+H2O+CO32-="2" HCO3-.
故答案为:CO2+H2O+CO32-="2" HCO3-.
本题难度:一般
5、选择题 当钠着火时,应选用灭火的是
A.煤油
B.水
C.沙土
D.泡沫灭火器
参考答案:C
本题解析:煤油是易燃物,钠与水会发生放热反应,过氧化钠会与二氧化碳发生反应,因此用沙土可以灭火,C选项符合题意。
点评:本题抓住钠与水会发生反应的性质,所以不能用惯性思维来解答,需要针对钠的特殊性来分析。
本题难度:简单