1、填空题 (14分)某无色溶液X,K+、Ba2+、Al3+、Fe3+、[Al(OH)4]-、CO32-、SO42-中的若干种离子组成,取该溶液进行如下实验:
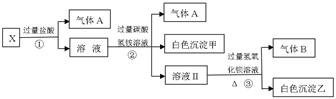
(1)气体A的成分是?(填化学式,下同),气体B的成分是?。
(2)写出步骤①中产生气体的离子方程式?。
(3)分别写出形成白色沉淀甲和气体B的离子方程式
?;?。
(4)通过上述实验,可确定X溶液中一定存在的离子是?,
尚未确定是否存在的离子是?,只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是?。
参考答案:(1)CO2? NH3
(2)CO32- + 2H+ ==CO2↑+ H2O
(3)Al3+ + 3HCO3-= Al(OH)3↓ + 3CO2↑;NH4++OH-=NH3↑+ H2O
(4)K+、 [Al(OH)4]-、CO32-; SO42-;?向沉淀乙加入足量的HCl,如果沉淀完全溶解说明没有SO42-,如果沉淀部分溶解说明有SO42-
本题解析:略
本题难度:简单
2、选择题 NA为阿伏加德罗常数,下列说法正确的是
A.10 g甲烷所含有的电子数目为10 NA
B.常温常压下,4 g氦气所含有的中子数目为4 NA
C.标准状况下,22.4 L单质溴所含有的原子数目为2 NA
D.电解食盐水若产生2 g氢气,则转移的电子数目为2 NA
参考答案:D
本题解析:A选项10 g甲烷含电子数6.25 NA;B选项4 g氦气含中子数2 NA;C选项标准状况下,溴是液态的.
本题难度:一般
3、选择题 下列分离或提纯物质的方法正确的是
[? ]
A、用过滤的方法除去NaCl溶液中的少量的淀粉胶体
B、用溶解、过滤的方法提纯含少量BaSO4的BaCO3
C、用加热蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
D、去除FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
参考答案:D
本题解析:
本题难度:一般
4、选择题 血液属于胶体,透析是除去肾衰竭病人血液中的毒性物质,从而拯救病人生命的重要方法。透析的原理是?(?)
A.蒸发
B.电泳
C.过滤
D.渗析
参考答案:D
本题解析:本题是对几种物质分离提纯方法的考查,注意把握各种方法的定义和适用对象即可得出结果。渗析是分离胶体和溶液离子的常见方法,而病人体内的蛋白质等高分子营养物质不能透过半透膜,而一些毒性物质分子或离子可以透过。
本题难度:一般
5、选择题 某稀硫酸和稀硝酸的混合溶液200? mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6? g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是

A.原混合酸中NO3-物质的量为0.1 mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为2.5 mol·L-1
参考答案:A
本题解析:试题分析:A、根据图像可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以每份混合酸中n(NO3-)=n(Fe)=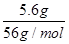 =0.1mol,所以原混合酸中NO3-物质的量为0.1? mol×2=0.2mol,故A不正确;B、由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故B正确;C、硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故C正确;D、反应最终消耗14.0g铁,物质的量=14.0g÷56g/mol=0.25mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒可知,每份含硫酸0.25mol,所以硫酸的浓度是0.25mol÷0.1L=2.5mol/l,故D正确,答案选A。
=0.1mol,所以原混合酸中NO3-物质的量为0.1? mol×2=0.2mol,故A不正确;B、由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故B正确;C、硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故C正确;D、反应最终消耗14.0g铁,物质的量=14.0g÷56g/mol=0.25mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒可知,每份含硫酸0.25mol,所以硫酸的浓度是0.25mol÷0.1L=2.5mol/l,故D正确,答案选A。
考点:考查金属铁与硝酸、硫酸反应的有关计算
本题难度:困难