1、选择题 实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取的质量Na2CO3分别为( )
A.1000mL?212g
B.950mL?201.4g
C.500mL?286g
D.1000mL?201.4g
参考答案:A
本题解析:
本题难度:简单
2、填空题 某同学按下列步骤配制100mL?1.00mol/LNaCl溶液.
①计算所需NaCl固体的质量
②称量NaCl固体
③将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解
④将烧杯中的溶液注入容量瓶(已检查是否漏液),并用少量蒸馏水洗涤烧杯2~3次,洗涤液也注入容量瓶
⑤向容量瓶中加蒸馏水至距刻度线1~2cm处
⑥将容量瓶盖紧,振荡,摇匀
请回答有关问题:
(1)用托盘天平称量固体NaCl的质量为______g.
(2)为了加速溶解,可以采取的措施是______.
(3)使用容量瓶的规格是______?mL.
(4)该同学实验中明显缺少的一步操作是______.
(5)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求______(填“大”或“小”)了.
参考答案:(1)m=CVM=1.00mol/L×0.1L×58.5g/mol=5.9g,故答案为:5.9g;?
(2)为了加速固体的溶解可以采用搅拌的方法,故答案为:搅拌;?
(3)实验室有100mL的容量瓶,所以应该使用100mL的容量瓶,故答案为:100mL;
(4)向容量瓶中加蒸馏水至距刻度线1~2cm处时要进行定容,定容的操作方法是:用胶头滴管滴加水至凹液面最低处与刻度线平齐,故答案为:改用胶头滴管滴加水至凹液面最低处与刻度线平齐;?
(5)根据C=nV知,将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,导致溶质的物质的量偏小,则配制溶液的浓度偏小,故答案为:小.
本题解析:
本题难度:一般
3、选择题 下列溶液与50mL?1mol/L的AlCl3溶液中氯离子数目相等的是( )
A.150mL1mol/L的NaCl
B.50mL2mol/L的NH4Cl
C.150mL3mol/L的KCl
D.50mL2mol/L的CaCl2
参考答案:50mL1mol/L的AlCl3溶液中氯离子的物质的量为0.05L×1mol/L×3=0.15mol,
氯离子的物质的量相同时,则氯离子数目相等,
A、NaCl中氯离子的物质的量为0.15L×1mol/L=0.15mol,故A选;
B、NH4Cl中氯离子的物质的量为0.05L×2mol/L=0.1mol,故B不选;
C、KCl中氯离子的物质的量为0.15L×3mol/L=0.45mol,故C不选;
D、CaCl2中氯离子的物质的量为0.05L×2mol/L×2=0.2mol,故D不选;
故选A.
本题解析:
本题难度:简单
4、实验题 配制1.50mol·L-1的NaOH溶液100mL:
(1)某学生操作如下:
①用托盘天平称出6.00g氢氧化钠:将天平调好零点,再在两盘上各取一张同样质量的纸,把游码调到1.00g的位置上,再于左盘放粒状氢氧化钠,右盘放上砝码至天平平衡,取下称好的氢氧化钠,并撤掉两盘上的纸。
②把称好的氢氧化钠放入一只100mL的烧杯中,加入约10mL水,搅拌使之溶解,溶解后立即用玻璃棒引流将溶液移至一只100mL的容量瓶内,加水至离刻度线约2cm处,用滴管加水至刻度线。
③写出一个标有配制日期的“0.25mol·L-1NaOH溶液”的标签,贴在容量瓶上密闭保存。指出上述操作中的7处错误
①__________________________;②_________________________
③__________________________;④_________________________
⑤__________________________;⑥_________________________
⑦__________________________
(2)下列操作造成所配溶液浓度偏高的是_______________
A.所用NaOH已经潮解;
B.用带游码的托盘天平称NaOH时误用了“左码右物”方法
C.未润洗溶解用的烧杯里;
D.未冷却到室温就注入容量瓶
E.定容时,俯视视刻度线;
F.托盘天平的砝码已生锈
参考答案:(1)①NaOH应放在干燥的烧杯中称量;②用过的游码未拨回原处;③托盘天平只能称出0.1g,称不出1.00g;④烧杯和玻璃棒未洗涤,洗涤液也应转入容量瓶;⑤溶解NaOH应冷却后再转移至容量瓶中;
⑥容量瓶中的溶液未摇匀;⑦配好的溶液应及时转移到有胶塞的试剂瓶内
(2)DEF
本题解析:
本题难度:一般
5、简答题 现有36%的醋酸(CH3COOH),密度为1g/ml,欲配制0.1mol/L的醋酸250ml,需要取用36%的醋酸______
ml.需要使用的实验仪器有烧杯、量筒、玻璃棒、______、____________若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度______(填“正确”、“偏大”或“偏小”).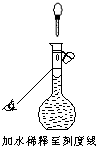
参考答案:36%的醋酸的物质的量浓度为c=1000×1×36%60mol/L=6mol/L,根据稀释定律,稀释前后溶质的物质的量不变,来计算36%的醋酸的体积,设36%的醋酸的体积为xmL,所以xmL×6mol/L=250mL×0.1mol/L,解得:x≈4.2.
所需36%的醋酸的体积为4.2mL.
操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)36%的醋酸,在烧杯中稀释,用玻璃棒搅拌,恢复室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
由提供的仪器可知还需要仪器有:250mL容量瓶、胶头滴管.
由图可知定容时仰视刻度线,导致所配溶液体积增大,所以所配溶液浓度偏小.
故答案为:4.2mL;?250?ml容量瓶;?胶头滴管;?偏小.
本题解析:
本题难度:一般