1、选择题 下列溶液中有关物质的浓度关系正确的是? (? )
A.c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中:c (NH4HSO4) ﹥c(NH4HCO3) ﹥c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:C(Na+)﹥C(CH3COO-)﹥C(H+)﹥C(OH-)
C.1.0mol/LNa2CO3溶液中:C(OH-)=C(HCO3-)+C (H+)+2C(H2CO3)
D.某二元弱酸的酸式盐NaHA溶液中:C(H+)+C(Na+)=C(OH-)+C(HA-)+C(A2-)
参考答案:C
本题解析:在三种盐溶液中都存在水解平衡:NH4++H2O NH3·H2O+OH-;由于在NH4HCO3中还存在平衡:HCO3-+H2O
NH3·H2O+OH-;由于在NH4HCO3中还存在平衡:HCO3-+H2O H2CO3-+H+;二者水解的酸碱性可以相互促进,使c(NH4+)减小。在NH4HSO4中电离产生的H+对NH4+水解起抑制作用,使c(NH4+)增大。因此c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中c(NH4HCO3) ﹥c(NH4Cl) ﹥c (NH4HSO4)。错误。B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,所以:C(H+)﹥C(OH-)。根据电荷守恒可得C(Na+)+ C(H+)=C(CH3COO-)+C(OH-)。将1式代入2式可得C(CH3COO-)﹥C(Na+)。盐的大量大于弱电解质的电离,所以C(Na+)﹥C(H+)。因此离子浓度的关系是:C(CH3COO-)﹥C(Na+)﹥C(H+)﹥C(OH-)。错误。C.1.0mol/LNa2CO3溶液中根据质子守恒可得:C(OH-)=C(HCO3-)+C (H+)+2C(H2CO3)。正确。D.某二元弱酸的酸式盐NaHA溶液中,根据电荷守恒可得:C(H+)+C(Na+)=C(OH-)+C(HA-)+2C(A2-)。错误。
H2CO3-+H+;二者水解的酸碱性可以相互促进,使c(NH4+)减小。在NH4HSO4中电离产生的H+对NH4+水解起抑制作用,使c(NH4+)增大。因此c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中c(NH4HCO3) ﹥c(NH4Cl) ﹥c (NH4HSO4)。错误。B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,所以:C(H+)﹥C(OH-)。根据电荷守恒可得C(Na+)+ C(H+)=C(CH3COO-)+C(OH-)。将1式代入2式可得C(CH3COO-)﹥C(Na+)。盐的大量大于弱电解质的电离,所以C(Na+)﹥C(H+)。因此离子浓度的关系是:C(CH3COO-)﹥C(Na+)﹥C(H+)﹥C(OH-)。错误。C.1.0mol/LNa2CO3溶液中根据质子守恒可得:C(OH-)=C(HCO3-)+C (H+)+2C(H2CO3)。正确。D.某二元弱酸的酸式盐NaHA溶液中,根据电荷守恒可得:C(H+)+C(Na+)=C(OH-)+C(HA-)+2C(A2-)。错误。
本题难度:一般
2、填空题 高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。

⑴请完成 与水反应的化学方程式:
与水反应的化学方程式:
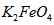 在处理水的过程中所起的作用是____________和_____________。
在处理水的过程中所起的作用是____________和_____________。
⑵将适量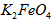 配制成c(
配制成c(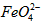 )=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(
)=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(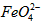 )的变化,结果见图I。第(1)题中的反应为
)的变化,结果见图I。第(1)题中的反应为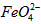 的变化的主反应,则温度对该反应的反应速率和平衡移动的影响是__________________;发生反应的△H_________0(填“﹥”、“﹤”或“=”)。
的变化的主反应,则温度对该反应的反应速率和平衡移动的影响是__________________;发生反应的△H_________0(填“﹥”、“﹤”或“=”)。
⑶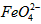 在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。
在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,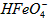 的分布分数先增大后减小
的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为: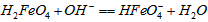
D.向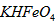 稀溶液加入水的过程中,pH可能增大也可能减小
稀溶液加入水的过程中,pH可能增大也可能减小
E.等体积等浓度的KOH溶液与溶液混合后溶液中的离子浓度大小关系为:

⑷Fe(OH)3在水中存在着沉淀溶解平衡:Fe(OH)3(s)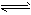 Fe3+(aq)+3OH-(aq),已知25℃时,溶度积常数
Fe3+(aq)+3OH-(aq),已知25℃时,溶度积常数
Ksp[Fe(OH)3]=4.0×10-38。某FeCl3溶液中c(Fe3+)=4.0×10-5 mol·L-1,在25℃时如果要生成Fe(OH)3沉淀,
需要向FeCl3溶液中加入碱溶液来调节溶液的pH,则必须使所得混合溶液的pH大于_________。
参考答案:⑴3O2;杀菌消毒;吸附净化?
⑵温度升高,反应速度加快,平衡向正反应方向移动;>
⑶BE
⑷3
本题解析:
本题难度:困难
3、选择题 相同物质的量浓度的NaCN 和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN 和HClO说法正确的是
A.酸根离子浓度:c(CNˉ)<c(ClOˉ)
B.电离程度:HCN>HClO
C.pH:HClO>HCN
D.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
参考答案:
本题解析:盐类水解的规律是:有弱才水解,谁弱谁水解,谁强显谁性。越弱越水解。相同物质的量浓度的NaCN 和NaClO相比,NaCN溶液的pH较大。说明CN-水解程度比ClO-大。即在相同温度下,相同浓度的HCN 和 HClO,电离程度HClO>HCN 。电离程度越大。溶液中的离子浓度越大,溶液的酸性越强,溶液的PH就越小来源:91exam .org。HCN 和 HClO都是一元酸,同体积同浓度的HCN 和 HClO酸的物质的量相同,中和碱的能力也相同。所以正确选项为:A。
本题难度:一般
4、选择题 与CaC2一样,Mg3C2也是离子晶体,与水能发生复分解反应。关于Mg3C2的叙述正确的是
A.与水反应有乙炔生成
B.与水反应有Mg(OH)2生成
C.有C-C键
D.有C22-离子
参考答案:BC
本题解析:A.Mg3C2与水的反应为Mg3C2+6H2O═3Mg(OH)2↓+C2H6,生成乙烷,故A错误;B.Mg3C2与水的反应为Mg3C2+6H2O═3Mg(OH)2↓+C2H6,故B正确;C.Mg3C2是离子晶体,存在离子键和C-C非极性共价键,故C正确;D.Mg3C2是离子晶体,有3个镁离子,则不会有C22-离子,故D错误;
故选BC.
本题难度:一般
5、选择题 某溶液中由水电离出来的C(OH—)=10-12mol/L,则该溶液中的溶质不可能是
A.HCl
B.NaOH
C.NH4Cl
D.H2SO4
参考答案:C
本题解析:溶液中由水电离出来的C(OH—)=10-12mol/L,即该溶液可能是酸溶液也可能是碱溶液,抑制水的电离;所以不可能的为C;加入氯化铵将促进水的电离;
本题难度:一般