|
高考化学知识点归纳《物质的量》高频考点特训(2017年练习版)(二)
2018-03-17 05:35:15
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 0.5L 1mol/L FeCl3溶液中的Cl-的物质的量浓度为
A.3 mol/L
B.1.5 mol/L
C.1 mol/L
D.0.5 mol/L
|
参考答案:A
本题解析:浓度与溶液的体积大小无关,0.5L 1mol/L FeCl3溶液中的Cl-的物质的量浓度为3 mol/L,是FeCl3溶液浓度的3倍;
本题难度:一般
2、填空题 Ⅰ.有以下几种物质:①食盐晶体 ②乙醇 ③水银 ④蔗糖 ⑤冰醋酸(纯醋酸晶体)
⑥KNO3溶液 ⑦熔融的氢氧化钠 ⑧液态氯化氢 填空回答(填序号):
(1)物质中构成的微粒只能在固定位置上振动的是 ;(2)以上物质可以导电是 ;
(3)以上物质中属于电解质的是 ; (4)以上物质中属于非电解质是 。
Ⅱ.(1)O2、SO2、SO3三者质量之比为1∶2∶5,则它们的氧原子数之比为 。
(2)某金属氯化物MCl2 40.5 g中含有0.6 mol Cl-,则MCl2的摩尔质量为 ,金属M的相对原子质量为 。(3)在V LFe2(SO4)3溶液中含有m g Fe3+,则CFe3+为_______________;从中取出V/4L溶液,则SO42-物质的量浓度为_______________;再将这V/4L溶液溶液稀释到4L,稀释后溶液中溶质的物质的量浓度为___________________。
参考答案:Ⅰ(1)①④⑤;(2)③⑥⑦;(3)①⑤⑦⑧;(4)②④
Ⅱ.(1)1:1:3 (2)135g/mol 64 (3) m/56V mol/L;3m/112V mol/L;m/1792 mol/L
本题解析:Ⅰ、(1)组成物质的微粒之间存在相互作用,各微粒之间既有相互吸引力,又有相互排斥力,当微粒距离较近时,排斥力的作用明显,将微粒推开,当微粒距离较大时,吸引力的作用明显,将微粒拉近,所以通常微粒在较平衡的位置上做极小的运动,即只能在各自平衡位置附近做微小振动,选①④⑤;(2)含有自由移动离子或电子的物质能导电,③水银 中含有自由的电子,所以能导电,⑥KNO3溶液、⑦熔融的氢氧化钠中含有自由移动的离子,所以能导电,选③⑥⑦;(3)①食盐晶体、⑤纯醋酸、⑦熔融的氢氧化钠、⑧液态氯化氢溶于水都能导电,且都是化合物,所以都是电解质,选①⑤⑦⑧;(4)②乙醇和④蔗糖在水溶液里或熔融状态下都以分子存在,所以都是非电解质,选②④。
Ⅱ.(1)根据n=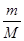 = =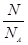 可知,O2、SO2、SO3三者质量之比为1:2:5,则O2、SO2、SO3的物质的量之比为: 可知,O2、SO2、SO3三者质量之比为1:2:5,则O2、SO2、SO3的物质的量之比为: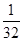 : :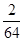 : :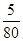 =1:1:2,它们的氧原子数之比为:1×2:1×2:2×3=1:1:3;(2)金属氯化物MCl2,40.5g中含有0.6mol Cl-,则40.5gMCl2的物质的量为:0.6mol× =1:1:2,它们的氧原子数之比为:1×2:1×2:2×3=1:1:3;(2)金属氯化物MCl2,40.5g中含有0.6mol Cl-,则40.5gMCl2的物质的量为:0.6mol×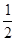 =0.3mol,则MCl2的摩尔质量为: =0.3mol,则MCl2的摩尔质量为: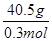 =135g/mol;M的相对原子质量为:135-35.5×2=64;(3)在V LFe2(SO4)3溶液中含有mg Fe3+,铁离子的物质的量为: =135g/mol;M的相对原子质量为:135-35.5×2=64;(3)在V LFe2(SO4)3溶液中含有mg Fe3+,铁离子的物质的量为: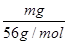 = =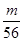 mol,铁离子的物质的量浓度为:c(Fe3+)= mol,铁离子的物质的量浓度为:c(Fe3+)=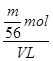 = =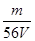 mol/L;该溶液中硫酸根离子浓度为:c(SO42-)= mol/L;该溶液中硫酸根离子浓度为:c(SO42-)=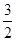 c(Fe3+)= c(Fe3+)=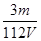 mol/L,溶液具有均一性,则从中取出 mol/L,溶液具有均一性,则从中取出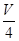 L溶液中SO42-物质的量浓度仍然为 L溶液中SO42-物质的量浓度仍然为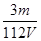 mol/L;再将这 mol/L;再将这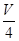 L溶液溶液稀释到4L,稀释过程中溶质的物质的量不变,稀释前Fe2(SO4)3的物质的量浓度为:c[Fe2(SO4)3]= L溶液溶液稀释到4L,稀释过程中溶质的物质的量不变,稀释前Fe2(SO4)3的物质的量浓度为:c[Fe2(SO4)3]= 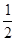 c(Fe3+)= c(Fe3+)=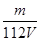 mol/L,则稀释后Fe2(SO4)3溶液中溶质的物质的量浓度为:c[Fe2(SO4)3]= mol/L,则稀释后Fe2(SO4)3溶液中溶质的物质的量浓度为:c[Fe2(SO4)3]= 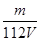 mol/L× mol/L×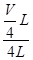 = =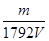 mol/L。 mol/L。
考点:考查电解质、非电解质,物质的导电性,阿伏加德罗定律及推导。
本题难度:一般
3、选择题 实验室常用98%(密度为1.84 g·mL-1)的浓硫酸配制1∶4的稀硫酸,此稀硫酸的密度为1.23 g·mL-1,则其物质的量浓度为(? )
A.4.6 mol·L-1
B.5.7 mol·L-1
C.3.88 mol·L-1
D.18.4 mol·L-1
参考答案:C
本题解析:c=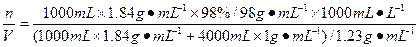 ="3.88" mol·L-1 ="3.88" mol·L-1
本题难度:简单
4、选择题 下列物质中所含分子的物质的量最多的是
A.1.5 mol O2
B.56g N2
C.33.6LCl2(标准状况)
D.3.01×1023个SO2分子
参考答案:B
本题解析:略
本题难度:简单
5、填空题 要准确掌握化学用语及常用计量方法。按要求回答下列问题:
(1)NA表示阿伏加德罗常数。28g乙烯和环丁烷(C4H8)的混合气体中含有____NA个碳原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol37Cl中,中子数比质子数多_______ NA个;1L 1mol/LFe2(SO4)3溶液中含_____NA个SO42-离子。
(2)图中A、B分别是某微粒的结构示意图,回答下列问题:

①若A表示某元素的原子,则y=?。
②若B表示某稀有气体元素的原子,则该元素的单质的化学式为?,若B是阴离子的结构示意图,则x的取值范围是________________。
(3)RxO42-中R的化合价为___________(用含x 的式子表示),当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子,则x=__________。
(4)将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则原硫酸的物质的量浓度为______________。
参考答案:(1)2,2,3,3(每空均为1分)
(2)①6(1分);②Ar(1分,写名称不得分),14≤x≤17
(3)+6/x; 1或2(答对一个得1分)?(4)4mol/L(无单位扣1分)
本题解析:(1)乙烯和环丁烷(C4H8)的最简式都是CH2,所以28g乙烯和环丁烷(C4H8)的混合气体中碳原子的物质的量=28g÷14g/mol=2mol。因此若NA表示阿伏加德罗常数,则28g乙烯和环丁烷(C4H8)的混合气体中含有2NA个碳原子;分子总数为NA个的NO2和CO2混合气体的物质的量是1mol,由于NO2和CO2均是含有2个氧原子的,所以分子总数为NA个的NO2和CO2混合气体含2NA个氧原子数;在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以1mol37Cl中,中子数比质子数多(37-17-17)×NA=3 NA个;1L 1mol/LFe2(SO4)3溶液中溶质硫酸铁的物质的量=1L×1mol/L=1mol,在溶液中硫酸铁的电离方程式为Fe2(SO4)3=2Fe3++3SO42-,所以溶液中含3NA个SO42-离子。
(2)①若A表示某元素的原子,则核外电子数=质子数,即2+y=8,所以y=6。
②若B表示某稀有气体元素的原子,则该元素的质子数=2+8+8=18,因此则该元素是Ar,其的单质的化学式为Ar。若B是阴离子的结构示意图,则B是第三周期的非金属,因此x的取值范围是14≤x≤17。
(3)氧元素的化合价是-2价,则 RxO42-中R的化合价为+(8-2)÷x=+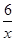 ?(用含x 的式子表示)。当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子。由于RO2中R元素的化合价是+4价,如果反应中R元素的化合价从+ ?(用含x 的式子表示)。当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子。由于RO2中R元素的化合价是+4价,如果反应中R元素的化合价从+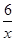 降低到+4价,则0.3mol×( 降低到+4价,则0.3mol×(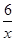 -4)×x=0.6mol,解得x=1。如果反应中R元素的化合价从+ -4)×x=0.6mol,解得x=1。如果反应中R元素的化合价从+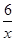 升高到+4价,则0.3mol×(4- 升高到+4价,则0.3mol×(4-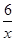 )×x=0.6mol,解得x=2。 )×x=0.6mol,解得x=2。
(4) 将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则根据原子守恒可知,硫酸盐中SO42-的质量=46.2g-7.8g=38.4g,物质的量=38.4g÷96g/mol=0.4mol,因此原硫酸的物质的量也是0.4mol,其浓度=0.4mol÷0.1L=4.0mol/L。
本题难度:一般
|