| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《水的电离平衡》高频试题强化练习(2017年最新版)(一)
3、填空题 (10分)有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
①A、C溶液的pH均大于7,A、B的溶液中水的电离程度比纯水大,A、D焰色反应的火焰均为黄色; ②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。 请填写下列空白: (1)A是___________,B是___________,C是____________,D是___________。 (2)常温,将1 mL pH =12的C溶液加水稀释至100mL,所得溶液中 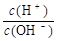 = 。 = 。(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。 (4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 。 4、填空题 (1)常温下,将2种一元酸分别和NaOH溶液等体积混合,实验数据如下:
①甲组实验的混合溶液中离子浓度由大到小顺序为 。由水电离出的c(OHˉ)= mol/L。 ②乙组实验中HY为强酸,则HY溶液的c1 (填“<”、“=”或“>”)0.1。 (2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况和n(NO)/n(CO)比例变化情况如下图。 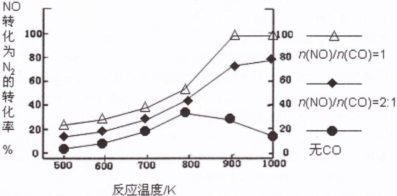 ①为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别为 、 。 ②用CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO2发生反应的化学方程式为 。 (3)工业上一般在恒容密闭容器中采用下列反应合成甲醇: CO(g) + 2H2(g)  CH3OH(g) △H CH3OH(g) △H下表所列数据是该反应在不同温度下的化学平衡常数(K)。
①由表中数据判断△H 0(填“<”、“=”或“>”)。 ②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为 。 ③请在下列坐标中画出②中求得该温度下CO、H2和CH3OH的浓度随时间变化的曲线,并进行适当的标注。  5、填空题 在水的电离平衡中, |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《物质的组成.. | |