1、填空题 用如图所示的装置进行电解。A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。则:
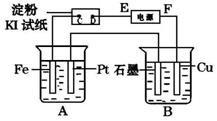
(1)电源的F端为_____________极。
(2)A中发生反应的化学方程式为________________。
(3)在B中观察到的现象是____,_________,_________
(4)室温下,若从电解开始到时间t s,A、B装置中共收集到标准状况下的气体0.168L,,B中析出硫酸钠晶体(Na2SO4﹒10H2O) ωg。若电解过程中无其他副反应发生,经测定电解后,A中溶液体积恰为1000mL,则①A溶液的pH为______________。
②电解前饱和Na2SO4溶液的质量分数为________________(列出算式即可。)
参考答案:(1)正(2)4AgNO3+2H2O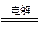 4Ag+O2?+4HNO3
4Ag+O2?+4HNO3
(3)石墨极有气泡产生,Cu极周围变蓝色?溶液中有蓝色沉淀生成
(4)①2?②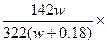 100%
100%
本题解析:略
本题难度:一般
2、填空题 锂离子电池的广泛应用使回收利用锂资源成为重要课题.某研究性小组对废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、碳粉和铝箔)进行资源回收研究,设计实验流程如下:
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.

(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是______.
(2)写出生成沉淀X的离子方程式______.
(3)写出反应②的化学反应方程式______.
(4)反应③在实际操作中采用加入过量的Na2CO3固体而不是Na2CO3溶液,这样做的目的是______,操作过滤Ⅲ分离出滤渣Li2CO3后所得滤液中的主要成份为______.(写化学式)
参考答案:第一步就是铝溶解在氢氧化钠溶液中(注意LiMn2O4不溶于水)生成四羟基合铝酸钠,即滤液的主要成分,第二步就是四羟基合铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠的过程,第三步是LiMn2O4在酸性环境下能被空气中的氧气氧化发生的氧化还原反应,得到的滤液中有生成的硫酸锂,可能有过量的硫酸,最后一步加入碳酸钠之后所得的滤液主要成分为硫酸钠;
(1)粉碎废料,能增大废料与氢氧化钠溶液的接触面积,加快反应速率.
故答案为:增大接触面积,加快反应速率.
(2)四羟基合铝酸钠与过量二氧化碳反应得产物是Al(OH)3沉淀和碳酸氢钠,
所以离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
(3)在酸性环境下,LiMn2O4能被空气中的氧气氧化,生成二氧化锰、硫酸锂和水,所以化学方程式为:
4LiMn2O4+2H2SO4+O2=8MnO2+2Li2SO4+2H2O.
故答案为:4?LiMn2O4+2?H2SO4+O2=8MnO2+2?Li2SO4+2H2O.
(4)碳酸钠溶液中含有水,能增大碳酸锂的溶解,而使溶液中的锂离子沉淀不完全,所以用碳酸钠固体不用碳酸钠溶液;通过上面分析知,最后所得滤液中的主要成分为硫酸钠.
故答案为:使溶液中的Li+沉淀完全,减少Li2CO3的溶解,Na2SO4.
本题解析:
本题难度:一般
3、选择题 已知某镍镉(Ni-Cd) 可充电电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O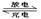 Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
A.放电时Cd电极发生氧化反应
B.放电时电解质溶液中的OH-向负极移动
C.放电时负极附近溶液的碱性不变
D.充电时阳极反应:Ni(OH)2+OH—+e—=NiOOH+H2O
参考答案:AB
本题解析:从化合价分析,放电时Cd从0价升高为+2价,被氧化,发生氧化反应,A正确;放电时Cd失去电子形成Cd2+,做电源负极,因此吸引溶液中阴离子OH-往负极移动,碱性增强,形成Cd(OH)2 ,B正确,C错误;充电时,阳极发生氧化反应失去电子,所以D项错误。故选AB。
本题难度:一般
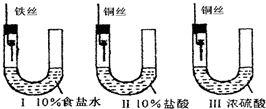
4、选择题 为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存一星期后,下列对实验结束时现象描述不正确的是( )
A.装置Ⅰ左侧的液面一定会上升
B.左侧液面装置Ⅰ比装置Ⅱ的低
C.装置Ⅱ中的铁钉腐蚀最严重
D.装置Ⅲ中的铁钉几乎没被腐蚀