1、选择题 对于反应2SO2(g)+O2(g)  2SO3(g);△H<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图象不相符的是
2SO3(g);△H<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图象不相符的是

(0~t1:v(正)=v(逆);t1时改变条件,t2时重新建立平衡)
[? ]
A.增加氧气的浓度
B.增大压强
C.升高温度
D.加入催化剂
参考答案:C
本题解析:
本题难度:一般
2、填空题 已知:N2 (g) +3H2(g)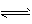 2NH3(g) △H = -92.4 kJ . mol-1。
2NH3(g) △H = -92.4 kJ . mol-1。
(1)在500℃、2.02×107Pa和铁催化条件下,于2L密闭容器中充入1 mol N2和3 mol H2,10 min 时达到平衡,有0.2 mol NH3生成,则10 min内用氮气表示的该反应的平均速率v(N2)为 ___,H2的转化率为___。
(2)充分反应后,放出的热量___(填“<”、“>”或“=”)92.4 kJ,理由是___。
(3)为有效提高氢气的转化率,实际生产中宜采取的措施有__。
A.降低温度
B.不断补充氮气
C.恒容下充入He来增大压强
D.升高温度
E.原料气不断循环
F.及时移出氨
(4)氨催化氧化制NO是在热的铂铑合金催化作用下进行的,反应为4NH3(g)+5O2(g)  4NO(g)+6H2O(g),反应过程中合金始终保持红热,该反应的化学平衡常数K的表达式为 ____,当升高温度时,K值___(填“增大”、“减小”或“不变”)。NH3的转化率在温度T1下随反应时间(t)的变化如图所示。其他条件不变,仅改变温度为T2(T2大于T1),在框图中用虚线画出温度T2下NH3的转化率随反应时间变化的预期结果示意图。
4NO(g)+6H2O(g),反应过程中合金始终保持红热,该反应的化学平衡常数K的表达式为 ____,当升高温度时,K值___(填“增大”、“减小”或“不变”)。NH3的转化率在温度T1下随反应时间(t)的变化如图所示。其他条件不变,仅改变温度为T2(T2大于T1),在框图中用虚线画出温度T2下NH3的转化率随反应时间变化的预期结果示意图。

参考答案:(1)0.005 mol·L-1·min-1;10%
(2)<;在101 kPa和298 K条件下,1 mol氮气和3 mol 氢气完全反应生成2 mol氨气,放出92.4 kJ热量,该反应为可逆反应,反应物不能全部转化为生成物;又因为反应温度为 500℃,所以放出的热量小于92.4 kJ
(3)BEF
(4) ;减小;
;减小;

本题解析:
本题难度:一般
3、选择题 COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:
COCl2(g) CO(g)+Cl2(g) △H <0。下列有关说法正确的是
CO(g)+Cl2(g) △H <0。下列有关说法正确的是
[? ]
A.在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
B.当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率
C.单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态
D.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
参考答案:B
本题解析:
本题难度:一般
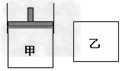
4、选择题 有两只密闭容器甲和乙。甲容器有一个可以移动的活塞能使容器内保持恒压,乙容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的M和N的混合气体,并使甲和乙容积相等(如图所示)。在保持400℃的条件下使之发生如下反应:2M(g)+N(g) 2Q(g),并达到平衡。下列说法正确的是
2Q(g),并达到平衡。下列说法正确的是
[? ]
A.甲容器达到平衡时所需的时间比乙容器长
B.平衡时甲容器中M的转化率比乙容器小
C.平衡后,若向两容器中通入数量不多的等物质的量的氩气,甲容器中化学平衡向逆反应方向移动,乙容器中化学平衡不移动
D.平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,甲容器的混合气体中Q的体积分数变小,乙容器的混合气体中Q的体积分数增大
参考答案:C
本题解析:
本题难度:一般
5、选择题 一定温度下,1 molX和n mol Y在体积为2L的密闭容器中发生如下反应:X(g)+Y(g)=2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )
A.用X表示此反应的反应速率是(0.1-0.2a)mol?(L?min)-1
B.当混合气体的质量不再发生变化时,说明反应达到平衡状态
C.向平衡后的体系中加入1mol M,平衡向逆反应方向移动
D.向上述平衡体系中再充入1mol X,v(正)增大,v(逆)减小,平衡正向移动
参考答案:A.5min后达到平衡,生成2amolZ,则参加反应的X的物质的量为2amol×12=amol,故v(X)=amol2L5min=0.1amol/(L?min),故A错误;
B.随反应进行,反应混合气体的质量减小,混合气体的质量不变,说明到达平衡,故B正确;
C.因固体和纯液体改变它的物质的量并不会改变它的浓度,因此化学平衡并不移动,故C错误;
D.向上述平衡体系中再充入1molX,反应物的浓度增大,生成物的浓度不变,所以v(正)增大,v(逆)不变,平衡向正反应移动,故D错误;
故选B.
本题解析:
本题难度:简单