1、填空题 物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中A、H为常见的金属单质,气体D、E为单质,试回答:
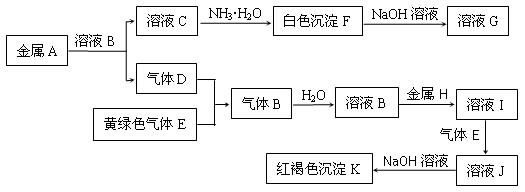
(1)A元素的原子结构示意图为 ________________
(2)写出下列物质的化学式:E是____________ , K是 _________
(3)化合物B属于 ____________化合物(填“离子”或“共价”)
(4)写出反应“F→G”的化学方程式:________________________________________
(5)写出反应“I→J”的离子方程式:_________________________________________
参考答案:(8分)(1)略? (1分)?
(2)E:Cl2? (1分)? K:Fe(OH)3 ?(1分)
(3)共价 (1分)?
(4)Al(OH)3 + NaOH = NaAlO2 + 2H2O?(2分)
(5) 2Fe2+ + Cl2 = 2Fe2++2Cl-?(2分)
本题解析:略
本题难度:简单
2、推断题 下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
已知:①反应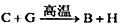 能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:
能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应: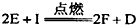 ,F中E元素的质量分数为60%。
,F中E元素的质量分数为60%。
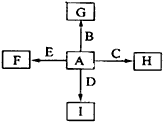
回答问题:
⑴①中反应的化学方程式为____________________;
⑵化合物I的电子式为_______________,它的空间结构是_______________;
⑶1.6gG溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需的铜粉的质量(写出离子方程式和计算过程)_________________;
⑷C与过量NaOH溶液反应的离子方程式为_______________,反应后溶于与过量化合物I反应的离子方程式为_______________________;
⑸E在I中燃烧观察到的现象是_______________。
参考答案:⑴Al+ Fe2O3 Fe+ Al2O3
Fe+ Al2O3
⑵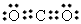 ;直线形
;直线形
⑶2Fe3++Cu=2Fe2++ Cu2+,n(Fe2O3)=0.01mol,依据离子方程式,则n(Cu)= 0.01mol,m(Cu)=0.64g。
⑷2Al + 2OH- + 2H2O==2AlO2- + 3H2↑;AlO2- + CO2 + 2H2O = Al(OH)3↓+ HCO3-
⑸剧烈燃烧,放出热量,生成黑色固体和白色固体
本题解析:
本题难度:一般
3、填空题 图是A~Z在一定条件下的转化关系(部分反应物或产物未列出).其中,A是生活中广泛使用的金属单质,常温下C是一种常见液体化合物,E、F、X均为气体.物质Y和Na2AO4均有强氧化性,可用于杀菌消毒,Z是一种红褐色固体.
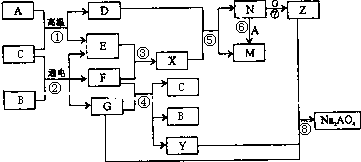
请回答下列问题:
(1)Y的电子式为______;
(2)在①~⑧中属于氧化还原反应,但又不是化合反应的是______(填序号);
(3)反应⑤的离子方程式是______;
(4)若在反应④中转移电子数为2NA,则消耗的F在标准状况下的体积是______L.
(5)反应⑧的化学方程式是______.
参考答案:A是生活中广泛使用的金属单质,常温下C是一种常见液体化合物,E、F、X均为气体.结合转化关系和反应条件,可以推断,A+C=D+E的反应是铁和水蒸气发生的反应;B+C通电电解得到EFG,EF为气体,判断是电解食盐水的反应,C为H2O,B为NaCl,A为Fe,E为H2,F为Cl2,G为NaOH,D为Fe3O4;X为HCl,N为FeCl3,M为FeCl2,Z为Fe(OH)3;
转化关系中的反应:F(Cl2)+G(NaOH)=C(H2O)+B(NaCl)+Y(NaClO);判断Y为NaClO;
(1)Y为NaClO电子式为:
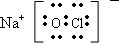
,故答案为:
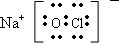
;
(2)在①~⑧中属于氧化还原反应,但又不是化合反应的是,①是铁和水蒸气发生的置换反应,是氧化还原反应;②电解氯化钠是氧化还原反应,不是化合反应;③氢气和氯气反应生成氯化氢,是氧化还原反应,属于化合反应;④是氯气和氢氧化钠反应是氧化还原反应,不是化合反应;⑤是四氧化三铁和盐酸反应,不是氧化还原反应不是化合反应;⑥是氯化铁和铁反应生成氯化亚铁,是氧化还原反应,是化合反应;⑦氯化铁和氢氧化钠反应是复分解反应;⑧是氧化还原反应,不是化合反应;综上所述②④⑧符合,
故答案为;①②④⑧;
(3)反应⑤是四氧化三铁和盐酸反应,反应的离子方程式是Fe3O4+8H+=2Fe3++Fe2++4H2O,故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(4)反应④是Cl2+2NaOH=NaCl+NaClO+H2O;1molCl2反应,电子转移1mol,反应中转移电子数为2NA,则反应的氯气为2mol,则消耗的F(Cl2)在标准状况下的体积为44.8L,
故答案为:44.8;
(5)反应⑧是氢氧化钠、氢氧化铁和次氯酸钠发生的反应生成Na2FeO4,铁元素化合价升高,氢氧化铁做还原剂,次氯酸钠做氧化剂被还原为氯离子,依据原子守恒配平写出
的化学方程式是:2Fe(OH)3+4NaOH+3NaClO=Na2FeO4+3NaCl+5H2O,故答案为:2Fe(OH)3+4NaOH+3NaClO=Na2FeO4+3NaCl+5H2O.
本题解析:
本题难度:一般
4、填空题 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体.在合适反应条件下,它们可以按下面框图进行反应;又知单质A是当今世界产量最大的金属,E的溶液是无色的.请回答:
(1)A是______,B是______,C是______(请填写化学式);
(2)反应①的化学方程式______;
(3)反应③的离子方程式______;
(4)反应④的离子方程式______.
参考答案:B为黄绿色气体,应为Cl2,单质A是当今世界产量最大的金属,应为Fe,则D为FeCl3,F能与Cl2反应生成FeCl3,则F应为FeCl2,则E为HCl的水溶液,C为H2,则
(1)由以上分析可知,A为Fe,B为Cl2,C为H2,故答案为:Fe,Cl2,H2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为2Fe+3Cl2?点燃?.?2FeCl3,故答案为:2Fe+3Cl2?点燃?.?2FeCl3;
(3)反应③为Fe和HCl的反应,反应的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(4)反应④为FeCl2和Cl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
本题解析:
本题难度:一般
5、填空题 现有常见金属单质A和气体甲、乙及物质B、C、D、E、F,它们之间能发生如下反应,已知B加入硫氰化钾溶液显血红色,气体乙显红棕色,(图中有些反应的产物和反应的条件没有全部标出)。
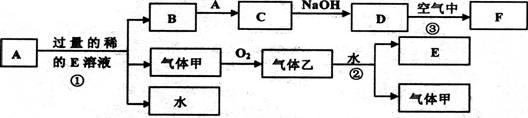
请根据以上信息回答下列问题:
(1)写出下列物质的化 学式:A ??,C ?
学式:A ??,C ?
(2)写出反应①的化学方程式?;
(3)写出反应②的化学方程式??;?
(4)B物质的阳离子用于制作印刷电路板的原理是(用离子方程式表示)?
(5)缺铁性贫血患者应补充C物质的阳离子,而B物质的阳离子则无这种药效。当用C物质的阳离子制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是?
如果药片已经失效,应如何检验?写出主要操作与现象:?。
参考答案:(1)Fe? Fe(NO3)2
(2)Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
(3)3NO2+2H2O=2HNO3+NO
(4)2Fe3++Cu =2Fe2++Cu2+
(5)保护Fe2+不被空气中的氧气氧化;取少量研碎的药片放入烧杯中,加适量的水溶解,然后滴加数滴KSCN溶液反应后溶液显红色,则表明该药片已部分或全部失效。
本题解析:略
本题难度:简单