1、填空题 (10分)已知A、B、C是单质,其中A是金属,各物质间的转化关系如图:
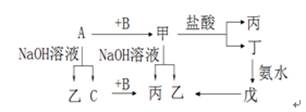
回答下列问题:(1)写出下列物质的化学式(各1分):
(1)A:________、B:________、乙:________、
丙:________、丁:________、戊:________
(2)写出A与NaOH溶液的化学方程式?;
写出丁生成戊的离子方程式?;
参考答案:(1)(各1分)A:Al、B:O2、乙:Na AlO2、丙:H2O、丁:AlCl3、戊:Al(OH)3
(2)(各2分)2Al+2NaOH+2H2O=2Na AlO2+3H2?
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
本题解析:考查铝及其化合物的转化
金属单质A可与NaOH溶液反应,可判定为铝,产物C为氢气,乙为Na AlO2;
铝与单质B化合生成甲,甲即可与盐酸反应,也可与NaOH溶液反应,应是两性氧化物Al2O3的性质,而B为氢气,丙为水,丁为AlCl3,AlCl3与氨水生成戊:Al(OH)3
本题难度:简单
2、填空题 已知:A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机等制造业;B是一种盐,在工农业生产中用途较广;C、F、H为常见非金属单质;常温下C、F、I、E、J和K为气体;E对空气的相对密度为0.586;常温常压下G为液体。有关物质间的转化关系如下(图中部分反应物或产物已省略):
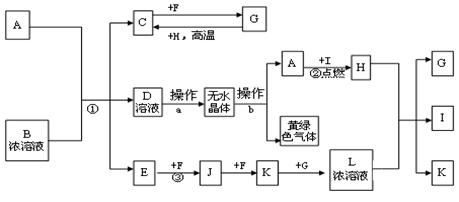
请填空:
(1)B的化学式为 ?。
(2)操作a必须在HCl气流中加热得无水物而不能直接加热浓缩,其原因是?;操作b为 ?。
(3)反应①的离子反应方程式为?。反应③的化学反应方程式为?。
参考答案:(1)NH4Cl?(2)抑制Mg2+的水解( 写方程式同样给分),?熔融状态下电解
(3)Mg+2NH4+=Mg2++H2↑+2NH3↑? 4NH3+5O2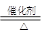 4NO+6H2O
4NO+6H2O
本题解析:根据题给信息和转化关系图分析,A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机等制造业,则A为镁;E对空气的相对密度为0.586,E的相对分子质量为17,E为氨气;常温常压下G为液体,G为水;黄绿色气体为氯气,结合流程图及相关物质的转化关系知,B是一种盐,为氯化铵,C为氢气,D为氯化镁,F为氧气,H为碳,I为二氧化碳,J为一氧化氮,K为二氧化氮,L为硝酸;(1)B为氯化铵,化学式为NH4Cl;(2)操作a为由氯化镁溶液中得无水氯化镁,氯化镁为强酸弱碱盐,为抑制Mg2+的水解,必须在HCl气流中加热得无水物;操作b为熔融状态下电解;(3)反应①为镁和氯化铵溶液反应生成氢气、氨气和氯化镁,离子反应方程式为Mg+2NH4+=Mg2++H2↑+2NH3↑;反应③为氨的催化氧化,化学反应方程式为4NH3+5O2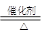 4NO+6H2O。
4NO+6H2O。
本题难度:一般
3、推断题 甲、乙、丙、丁为4种单质,其中甲、乙、?丙为短周期主族元素的单质,常温下均为气态;丁是日常生活中一种常见的金属。甲、乙、丙、丁生成X、Y、Z、W?四种化合物的转化关系如下:?
甲?+?丙 X?,甲?+?丁
X?,甲?+?丁 Y,丙?+?乙
Y,丙?+?乙 Z?,丁?+?乙
Z?,丁?+?乙 W
W
其中常温下X是无色液体,Y是黑色固体。丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成红棕色的烟,W的水溶液呈黄色。
请推断后回答:
(1)写出下列反应的化学方程式:
甲 + 丙 X :___________________
X :___________________
甲 + 丁 Y:___________________
Y:___________________
丙 + 乙 Z :___________________
Z :___________________
丁 + 乙 W:___________________
W:___________________
实验室制取乙物质的化学反应方程式:__________________
(2)已知丙和乙生成Z的过程中,破坏1mol丙的化学键消耗能量Q1kJ,破坏1mol乙的化学键消耗能量Q2 kJ,形成1mol Z的化学键放出能量Q3 kJ。则Q1、Q2、Q3的关系为_________________________。
参考答案:
(1)O2?+?2H2 2H2O;
2H2O;
? 2O2?+?3Fe Fe3O4;
Fe3O4;
? H2+Cl2 2HCl;
2HCl;
?2Fe?+3Cl2 2FeCl3 ;
2FeCl3 ;
? MnO2?+?4HCl MnCl2?+?Cl2?+?2H2O
MnCl2?+?Cl2?+?2H2O
(2)Q1+Q2<2Q3
本题解析:
本题难度:一般
4、填空题 (10分)以海水中常见物质A为原料可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题:
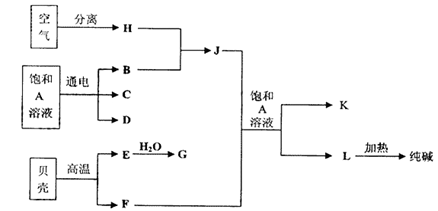
(1)电解A溶液反应的离子方程式为?;
(2)写出C与D制取消毒剂的化学方程式?;
(3)若要使工业合成J反应的平衡向生成J的方向移动,可采取的措施有?
A.升高温度? B.增大压强? C.使用催化剂? D.液化分离J
(4)将F和J通入A的饱和溶液中的顺序为?
A.先通入F后通入J ?B.先通入J后通入F
C.同时通入? D.没有先后顺序要求
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。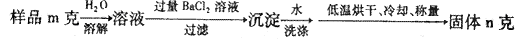
则计算样品中NaCl的质量分数的数学表达式为:??
参考答案:(1)2H2O+2Cl- ?Cl2↑+H2↑+2OH-?(2)Cl2 + NaOH="=NaClO" +NaCl +H2O?
?Cl2↑+H2↑+2OH-?(2)Cl2 + NaOH="=NaClO" +NaCl +H2O?
(3)B D?(4)B?(5)(1-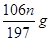 )
)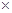 100%
100%
本题解析:(1)海水中含有氯化钠,所以A是氯化钠,电解的方程式为
2H2O+2Cl- Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(2)氯气溶于氢氧化钠溶液中甲生成消毒剂,方程式为Cl2 + NaOH="=NaClO" +NaCl +H2O。
(3)J是氨气,合成氨是体积减小的放热的可逆反应,所以BD可以是平衡向正反应方向移动。升高温度,平衡向逆反应方向移动。催化剂不能改变平衡状态,答案选BD。
(4)由于CO2在水中的溶解度不大,所以应该先通入氨气,然后再通入CO2,答案选B。
(5)n固体是碳酸钡,所以根据原子守恒可知,样品中碳酸钠的质量是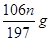 。样品中NaCl的质量分数的数学表达式为(1-
。样品中NaCl的质量分数的数学表达式为(1-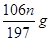 )
)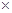 100%
100%
本题难度:一般
5、选择题 在一种酸性溶液中,存在NO3-、I一、Cl一、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此推断溶液中? (? )
A.一定有碘离子,不能确定是否含有氯离子
B.一定含有硝酸根离子
C.一定含有碘离子、氯离子、硝酸根离子
D.不含铁离子和硝酸根离子
参考答案:AD
本题解析:略
本题难度:简单