1、填空题 (20分)工业上用铬铁矿(主要成分FeO·Cr2O3,杂质为SiO2、Al2O3等)
生产重铬酸钾(化学式K2Cr2O7,)的流程如下:
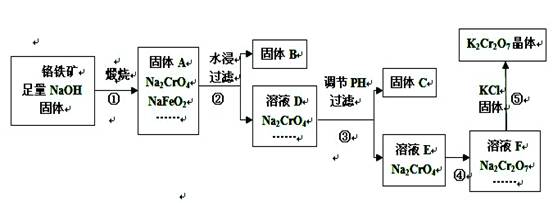
(1)固体A中,除Na2CrO4、NaFeO2、NaOH外还有?等;
(2)固体A水浸时,NaFeO2会发生强烈水解产生固体B,其化学反应方程
式为?;
(3)固体C中含有2种物质,要先加入下列物质中的?,然后才
能进行过滤分离。
A.氢氧化钠溶液?B.稀氨水?C.稀盐酸
(4)步骤④加入盐酸得到的溶液F中,除Na2 Cr2O7外,还含有的溶质
是?;
(5)在上述流程中,有氧化还原反应发生的是第____步。
(6)已知20℃时K2Cr2O7饱和溶液浓度为0.4 mol·L-1,步骤⑤中加入固
体氯化钾,若使K+离子浓度达到4 mol·L-1(保持温度20℃),则溶液F中Cr2O72-离子的浓度最大为?。
参考答案:(1)Na2SiO3、Na[Al(OH)4 ](4分)
(2)NaFeO2 + 2H2O =" NaOH" + Fe(OH)3(3分)
(3)C (3分)(4)NaCl(3分)(5)①(3分)(6)0.016 mol·L-1(4分)
本题解析:(1)铬铁矿中含有杂质SiO2、Al2O3所以当与固体氢氧化钠煅烧时会产生Na2SiO3和Na[Al(OH)4 ]两种物质
(2) NaFeO2会发生强烈水解产生固体B,水解的过程中没有化合价的变化,根据NaFeO2可以判断产物是Fe(OH)3,所以水解方程式为:
NaFeO2 + 2H2O =" NaOH" + Fe(OH)3
(3)固体C中含有2种物质是Al(OH)3和H2SiO3,Al(OH)3溶于盐酸,而H2SiO3不溶于盐酸,所以可以用盐酸将二者分开。
(4)由于加入盐酸得到的溶液F,所以F中肯定含有氯离子,再加上溶液中本来含有的钠离子,所以溶液中还含有的溶质是NaCl,
(5)铬铁矿中铬为+3价,与氢氧化钠煅烧后变为+6价,化合价发生变化,其他过程中均没有化合价的变化,所以上述流程中只有①是氧化还原反应。
(6)饱和溶液中的K2Cr2O7浓度为0.4 mol·L-1则可以知道,饱和溶液中C(K+)="0.8" mol·L-1,C(Cr2O72-)="0.4" mol·L-1,所以饱和时可以仿照沉淀溶解平衡计算溶液中的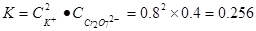 ,由于在同一温度下,所以K相同,根据K+离子浓度可以计算出Cr2O72-浓度的最大值,
,由于在同一温度下,所以K相同,根据K+离子浓度可以计算出Cr2O72-浓度的最大值,
本题难度:一般
2、填空题 目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
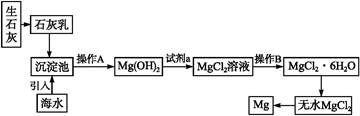
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是 ,写出在沉淀池中发生反应的离子方程式 。?
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。?
(3)操作A是 ,操作B是 。?
(4)加入的足量试剂a是 (填化学式)。?
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为 。从考虑成本和废物循环利用的角度,副产物氯气可以用于 。?
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
_____________________________________________
参考答案:(1)沉淀Mg2+[或使Mg2+形成Mg(OH)2沉淀](1分)
Mg2++2OH- Mg(OH)2↓(1分)
Mg(OH)2↓(1分)
(2)贝壳(或牡蛎壳等)(1分)
(3)过滤 蒸发结晶(或加热浓缩)(每空0.5分)
(4)盐酸(1分)
(5)MgCl2(熔融) Mg+Cl2↑(2分) 制盐酸,循环使用(1分)
Mg+Cl2↑(2分) 制盐酸,循环使用(1分)
(6)海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度增大且成本低(2分)
本题解析:(1)由框图我们可以看出加入石灰乳后生成了Mg(OH)2,很明显作用就是为了将Mg2+沉淀;(2)CaCO3 CaO+CO2↑,海洋中贝壳含有丰富的CaCO3;(3)由框图可知操作A是过滤,操作B是蒸发结晶;(4)从框图中可以看出由Mg(OH)2到MgCl2需加盐酸;(5)电解生成的Cl2可与H2反应生成HCl,循环使用。(6)海水中尽管含镁丰富,但浓度较小,之所以将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁就是为了把镁富集,且成本比较低。
CaO+CO2↑,海洋中贝壳含有丰富的CaCO3;(3)由框图可知操作A是过滤,操作B是蒸发结晶;(4)从框图中可以看出由Mg(OH)2到MgCl2需加盐酸;(5)电解生成的Cl2可与H2反应生成HCl,循环使用。(6)海水中尽管含镁丰富,但浓度较小,之所以将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁就是为了把镁富集,且成本比较低。
本题难度:一般
3、选择题 下列说法正确的是( )
A.生产水泥时,在熟料中加入适量的石膏可以调节水泥的硬化速度
B.水泥在水中能硬化,但在空气中不会硬化
C.水泥和水拌和后生成不同的水合物,要吸收一定的热量
D.水泥是一种化合物
参考答案:A
本题解析:
本题难度:一般
4、选择题 海水中蕴藏着丰富的资源。海水综合利用的示意图如下。

下列说法正确的是
A.通过氯碱工业可生产的产品有NaOH、NaClO、盐酸等
B.将卤水中Mg2+转化为氢氧化镁沉淀通常是向卤水加入氢氧化钠溶液
C.直接加热MgCl2·6H2O可得到较纯净的无水MgCl2
D.在高温下用铝还原MgCl2可制取金属镁
参考答案:A
本题解析:电解饱和的食盐水生成氢氧化钠、氯气和氢气。氯气和氢氧化钠反应可以生成次氯酸钠。氯气和氢气反应生成氯化氢,进而得到盐酸,A正确;B不正确,通常加入的是石灰乳;C不正确,因为镁离子水解,溶液显酸性,需要在氯化氢的气氛中加热MgCl2·6H2O可得到较纯净的无水MgCl2。镁是活泼的金属,应该用电解氯化镁的方法冶炼,D不正确,答案选A。
点评:该题是中等难度的试题,在注重对教材基础知识巩固和训练的同时,侧重对学生灵活运用基础知识解决实际问题的能力的培养,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:简单
5、填空题 化学不仅为人类生活创造了丰厚的物质基础,而且为人类社会可持续发展做出了巨大贡献。
(1)蛋白质是生命的基础,是日常膳食的重要组成部分。下列食物:①黄瓜 ②大豆 ③淀粉 ④鸡蛋 ⑤葡萄干,其中富含蛋白质的是______________(填序号)。
(2)钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人,造成钢铁锈蚀的主要原因是发生电化学腐蚀。在电化学腐蚀中,水膜酸性较弱或呈中性时,发生吸氧腐蚀,其电极反应为:正极:O2+2H2O+4e-=4OH-;负极:_____________________。水膜酸性较强时,发生析氢腐蚀,其电极反应为:正极:_________________ 。
(3)生活中的水泥、普通玻璃和陶瓷都属于_____________(填“金属材料”或“无机非金属材料”和“高分子合成材料”),其生产原料不需要使用石灰石的是______________。材料常常成为一个时代的标志,如陶器时代、青铜器时代、铁器时代。在信息时代,你认为信息技术的关键材料的的化学式是
______________。
(4)碳酸氢钠是常见的疏松剂和抗酸药,请写出作抗酸药时的离子方程式_______________________
参考答案:(1)②④
(2)Fe-2e-==Fe2+;2H++2e-==H2↑
(3)无机非金属材料;陶瓷;SiO2
(4)HCO3-+H+==H2O+CO2↑
本题解析:
本题难度:一般