1、选择题 用分子间作用力的观点,下列最适合溶解硫粉(S8)的溶剂是
A.水
B.CH3OH(甲醇)
C.CS2
D.CH3COOH(乙酸)
参考答案:C
本题解析:单质硫是非极性分子,根据相似相溶原理可知,应该易溶在非极性分子CS2中,ABD都是极性分子,答案选C。
本题难度:简单
2、选择题 X、Y、Z、M、R、W为六种短周期元素,原子序数依次递增。Y、Z、M是同周期元素,且Z、M最外层电子数之差为1。X+ 无电子,—ZX是有机物中常见官能团。Y是组成化合物最多的元素,组成为R ZX的物质能溶解W2Z3型物质。下列说法不正确的是
A.由X与Y组成的化合物的沸点可能高于由X与Z组成的化合物的沸点
B.X、Z、R三种元素中的任意两种组合成的(1∶1型)物质中均含有共价键
C.常压条件下,沸点:X2Z2>XM ;简单离子半径:Z>M>R>W
D.R 3WM6晶体可作为工业电解熔融W2Y3制W单质时的助熔剂
参考答案:B
本题解析:X+ 无电子,说明X为H,—ZX是有机物中常见官能团说明Z为O元素,Y是组成化合物最多的元素,说明Y为C元素,Z、M最外层电子数之差为1,则M为F元素,组成为RZX的物质能溶解W2Z3型物质,则R为Na元素,W为Al元素。A、X与Y组成的化合物为烃,X与Z组成的化合物为H2O,含碳较多的烃沸点可能高于H2O的沸点,正确;B、X、Z、R三种元素中的任意两种组合成的(1∶1型)物质可能为H2O2、Na2O2、NaH,NaH不含共价键,错误;C、常压条件下,沸点:H2O2>HF;简单离子半径:O2? > F? > Na+ >Al3+,正确;D、Na3AlF6晶体可作为工业电解熔融Al2O3制Al单质时的助熔剂,可降低Al2O3的熔点,正确。
本题难度:一般
3、填空题 元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
Ⅰ.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
镓(31Ga)的基态电子排布式是_________________________________________;
31Ga的第一电离能却明显低于30Zn,原因是______________________________________;
Ⅱ.第四周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为________________。NH3 分子中N原子的杂化方式为_______杂化,NH3分子的空间立体构型是____________。
(2)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是:__________________________________________(用相关的离子方程式和简单的文字说明加以解释)
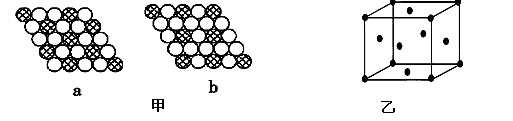
(3)如图甲所示为二维平面晶体示意图,所表示的化学式为AX3的是________。
(4)图乙为一个金属铜的晶胞,此晶胞立方体的边长为acm,Cu的相对原子质量为64,金属铜的密度
为ρ g/cm3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。
参考答案:Ⅰ、31Ga的电子排布式是:1s22s22p63s23d104s24p1? (2分)?
30Zn的4s能级处于全充满状态,较稳定?(2分)
Ⅱ、(1)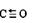 (只写三键没标明配位键的只给1分)(2分) SP3 (1分)?三角锥型(1分)
(只写三键没标明配位键的只给1分)(2分) SP3 (1分)?三角锥型(1分)
(2)蓝色沉淀与氨水可发生如下反应:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++4H2O+2OH-,
生成的[Cu(NH3)4]SO4在极性较小的乙醇中溶解度较小而析出。(3分)
(方程式正确给2分,其它回答正确也可得3分)
(3)b(2分)
(4)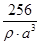 mol-1 ?(2分)
mol-1 ?(2分)
本题解析:Ⅰ、 31Ga的电子排布式是:1s22s22p63s23d104s24p130Zn的4s能级处于全充满状态,较
稳定Ⅱ(1)CO分子中碳和氧共用两对电子,氧提供一对电子配位;NH3是以氮原子为中心,三个氢
原子和氮的一对孤对电子,以sp3不等性杂化方式形成三角锥型
(2) 蓝色沉淀与氨水可发生如下反应:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++4H2O+2OH-,生成的[Cu(NH3)4]SO4在极性较小的乙醇中溶解度较小而析出。
(3)a图中一个黑的周围有6个相邻白点,一个白的周围有3个相邻黑点,黑:白=1:2
b图中一个黑的周围有6个相邻白点,一个白的周围有2个相邻黑点,黑:白=1:3故选b
(4)金属铜的晶胞为面心立方晶胞,含有6个面心,8个顶点,每个面心是两个晶胞所共用,顶点是8个晶胞所共用,平均每个晶胞中铜原子的个数为6×(1/2)+8×(1/8)=4,每个晶胞4个Cu原子。1mol 的Cu原子质量为64g,1mol的晶胞Cu原子质量就是4X64g
晶胞体积×晶胞密度×阿佛加德罗常数="4×64g" 计算可知:阿佛加德罗常数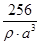 mol-1
mol-1
本题难度:一般
4、填空题 (1)下列是A、B、C、D、E五种短周期元素的某些性质。
?
| A
| B
| C
| D
| E
|
化合价
| -4
| -2
| -1
| -2
| -1
|
电负性
| 2.5
| 2.5
| 3.0
| 3.5
| 4.0
|
?
①E原子的核外电子排布式为________;
②上表中的元素可以组成分子式为ADC2的物质,该物质中所有原子最外层均满足8电子稳定结构。则该分子的结构简式为________;中心原子的杂化方式为________;
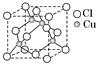
(2)铜的某种氯化物晶体的晶胞结构如图所示,该氯化物的化学式为________;
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________________。
参考答案:(1)①1s22s22p5 ②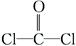 sp2
sp2
(2)CuCl
(3)NH3中的N呈-3价,易提供孤对电子,Cu2+提供空轨道形成配位键,而NF3中的N呈+3价,故N的原子核对其孤对电子的吸引力增强,难以提供孤对电子与Cu2+形成配位键。
本题解析:(1)根据表中给出的化合价及电负性数值可知A、B、C、D、E五种元素分别为C、S、Cl、O、F。②通过成键电子对数与孤电子对数可判断中心原子杂化类型。(3)根据晶胞的结构可知Cl位于立方体的顶点和面心上,每个晶胞内含有Cl的个数为8×1/8+6×1/2=4,铜位于晶胞内,其个数为4,由个数比可以判断出化学式为CuCl。
本题难度:一般
5、选择题 下列变化中不需要破坏化学键的是
[? ]
A.加热氯化铵
B.干冰气化
C.金刚石熔化
D.氯化氢溶于水
参考答案:B
本题解析:
本题难度:简单