1、填空题
氯化钠样品含有少量的Na2SO4和Na2CO3,按下列流程进行净化,
(1)请在流程中( )中写上合适的试剂,在[ ]中写上实验操作名称

(2)写出有关反应的化学方程式:
第步②__________________、___________________;
第步③__________________________;
第步⑤__________________________。
参考答案:(1)① 蒸馏水;溶解;② 过量BaCl2溶液;③ 过量Na2CO3溶液;④ 过滤;⑤ 稀盐酸;⑥ 蒸发结晶
(2)②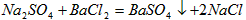 ;
;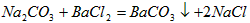
③
⑤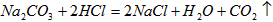
本题解析:
本题难度:困难
2、简答题 实验室合成乙酸乙酯的步骤如下:在园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
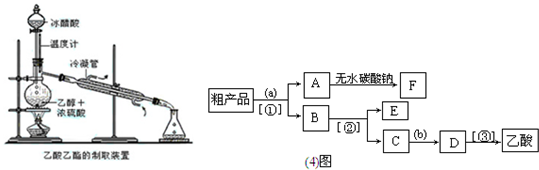
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:______.
(3)在该实验中,若用1mol乙醇和1mol?乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?______,原因是______
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图.请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法.试剂a是______,试剂b是______;分离方法①是______,分离方法②是______,分离方法③是______.
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是______
(6)写出C→D?反应的化学方程式______.
参考答案:(1)加入碎瓷片可防止液体暴沸,故答案为:防止烧瓶中液体暴沸;
(2)浓硫酸溶于水放出大量的热,且密度比水大,为防止酸液飞溅,应先在烧瓶中加入一定量的乙醇,然后慢慢将浓硫酸加入烧瓶,边加边振荡,
故答案为:先在烧瓶中加入一定量的乙醇,然后慢慢将浓硫酸加入烧瓶,边加边振荡;
(3)乙酸和乙醇制备乙酸乙酯的反应为可逆反应,反应物不能完全转化,
故答案为:否;该反应是可逆反应,反应不能进行到底;
(4)用饱和碳酸钠溶液分离混合物,经分液之后可得乙酸钠和乙醇的混合液,蒸馏后可得乙酸钠,加入硫酸后蒸馏可得乙酸,
故答案为:饱和碳酸钠溶液;浓硫酸;分液;蒸馏;蒸馏;
(5)无水碳酸钠能与水反应生成碳酸钠的结晶水合物,可用无水碳酸钠除去乙酸乙酯中的少量水,
故答案为:除去乙酸乙酯中混有的少量水;
(6)C→D?反应为硫酸与乙酸钠反应生成乙酸的过程,反应的化学方程式为2CH3COONa+H2SO4=Na2SO4+2CH3COOH,
故答案为:2CH3COONa+H2SO4=Na2SO4+2CH3COOH.
本题解析:
本题难度:一般
3、选择题 下列分离方法不正确的是
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用分液漏斗分离水和苯
参考答案:C
本题解析:泥沙难溶于水,故可用过滤的方法除去食盐水中的泥沙,A正确;
通过加热蒸馏将水变成水蒸气,再冷凝即可得到蒸馏水,故B正确;
酒精能与水互溶,故不可用做从碘水中萃取碘的萃取剂;
水和苯为互不相溶的液体,且水密度比苯小,故可用分液漏斗分离,水从下端管口放出,苯从上端管口倒出,故D正确;
本题难度:简单
4、选择题 天然色素的提取往往应用到萃取操作,现在有用大量水提取的天然色素,下列溶剂不能用来萃取富集这些天然色素的是
A.乙醇
B.苯
C.四氯化碳
D.直馏汽油
参考答案:A
本题解析:乙醇与水任意比例互溶,故不能用来做萃取剂
本题难度:简单
5、填空题 (2008年北京卷,理综,27)(3)用图示装置制备NO并验证其还原性。有下列主要操作:
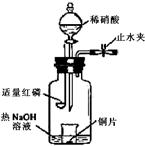
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是___________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是? ____________________________________________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是_____________________________________
______________________________________________________________________。反应的离子方程式是____________________________________________________。
参考答案:(3)①打开止水夹,通入少量氧气;②P2O5+6OH-=2PO43-+3H2O;③Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
本题解析:以教材铜和稀硝酸反应实验设计为主体,用集气瓶、带有止水夹的导管巧妙地将两个部分连接起来,形成完整的、科学的实验设计。实验原理是利用红磷燃烧消除O2,再用铜和稀硝酸反应制备NO,观察现象:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;然后打开止水夹,让空气进入该装置,看到红棕色出现,发生了2NO+O2=2NO2,确定NO有还原性。故步骤c后还缺少的一步主要操作是打开止水夹,通入少量氧气。
本题难度:简单