1、选择题 一定温度下,固定体积的容器中充入1 mol SO2和1 mol O2,再加入少量的NO,在体系中发生
①2NO+O2=2NO2;②SO2+NO2=SO3+NO,下列说法中不正确的是
[? ]
A.体系中的总反应是:2SO2+ O2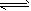 2SO3
2SO3
B.在反应过程中NO是催化剂
C.NO参与反应历程,降低反应活化能,加快反应速率
D.NO的引入可以增加SO2的平衡转化率
参考答案:D
本题解析:
本题难度:一般
2、选择题 在高温下反应2HBr(g)═H2(g)+Br2(g),△H>0达到平衡时要使混合气体颜色加深,可采取的方法是( )
A.减小压强
B.缩小体积
C.升温
D.增大H2的浓度
参考答案:A、减小压强平衡不移动,但体积增大,c(Br2)减小,混合气体的颜色变浅,故A错误;
B、缩小体积,压强增大,平衡不移动,c(Br2)增大,混合气体的颜色变深,故B正确;
C、该反应正反应是吸热反应,升高温度,平衡向正反应移动,c(Br2)增大,混合气体的颜色变深,故C正确;
D、增大氢气的浓度,平衡向逆反应移动,c(Br2)减小,混合气体的颜色变浅,故D错误;
故选BC.
本题解析:
本题难度:一般
3、选择题 在一定条件下,固定容积的密闭容器中的反应:2NO2(g)

?O2(g)+2NO(g);△H>0,达到平衡时,若改变其中一个条件X,Y随X的变化符合图中曲线的是( )
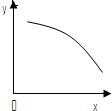
A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
参考答案:A、反应吸热,升高温度,平衡向正反应方向移动,NO2的物质的量减小,故A正确;
B、增大压强,平衡向逆反应方向移动,NO的转化率增大,故B错误;
C、达到平衡后,因混合气体的质量和体积不变,混合气体的密度不变,故C错误;
D、增加NO2的物质的量时,平衡向正方向移动,氧气的物质的量增加,故D错误.
故选A.
本题解析:
本题难度:一般
4、填空题 如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:A(g)+3B(g)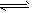 2C(g)
2C(g)
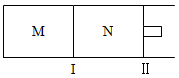
(1)向M、N中,各通入1mol A和3mol B。初始M、N容积相同,并保持温度不变。则到达平衡时A的转化率α(A)M________α(A)N,A的体积分数x(A)M________x(A)N
(2)向M、N中,各通入x molA和y molB,初始M、N容积相同,并保持温度不变。若要平衡时保持A气体在M、N两容器中的体积分数相等,则起始通入容器中的A的物质的量xmol与B的物质的量ymol之间必须满足的关系式为________
(3)若在某件下,反应A(g)+3B(g)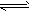 2C(g)在容器N中达到平衡,测得容器中含有A 1.0mol,B 0.4mol,C 0.4mol,此时容积为2.0L。则此条件下的平衡常数为____________;保持温度和压强不变,向此容器内通入0.36mol A,平衡将________(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由________________________________。
2C(g)在容器N中达到平衡,测得容器中含有A 1.0mol,B 0.4mol,C 0.4mol,此时容积为2.0L。则此条件下的平衡常数为____________;保持温度和压强不变,向此容器内通入0.36mol A,平衡将________(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由________________________________。
参考答案:(1)<;>
(2)x=y
(3)10;逆向;原平衡体系中,2.0L容器中含有分子1.0+0.4+0.4=1.8mol,当加入A,体系瞬间有分子1.8+0.36=2.16mol。瞬间总体积变为2.16×2.00/1.8=2.4L,所以
本题解析:
本题难度:一般
5、填空题 下表是部分短周期元素的原子半径和主要化合价。

用化学用语回答:
(1)七种元素中原子半径最大的元素在周期表中的位置___________,M的单质与R的最高价氧化物对应的水化物发生反应的化学方程式为_____________________。
(2)X可与R按1:1的原子个数比形成化合物甲,甲中存在的化学键类型有__________,X可与W组成含18电子的化合物乙,则乙的电子式为_______________。
(3)Y的氢化物比Q的氢化物稳定的根本原因______________________。
(4)在容积不变的密闭容器中进行如下反应:3W2(g)+Y2(g) 2YW3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是_________(填序号)。
2YW3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是_________(填序号)。
A.平衡不发生移动 B.平衡向逆反应方向移动
C.NH3的质量分数增加 D.正逆反应速率都增大
参考答案:(1)第三周期ⅠA族;2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(2)离子键、共价键或非极性共价键; ?
?
(3)氮的非金属性比磷的强
(4)“略”
本题解析:
本题难度:一般