1、选择题 以下事实不能用勒夏特列原理解释的是(? )
A.增大压强,有利于二氧化硫和氧气反应生成三氧化硫
B.工业制取硫酸和合成氨反应都要使用催化剂
C.合成氨工业生产中,把合成塔中的氨气不断抽出
D.实验室常用排饱和食盐水的方法收集氯气
参考答案:B
本题解析:二氧化硫催化氧化生成三氧化硫的反应是气体体积缩小的反应,增大压强,平衡向生成三氧化硫的方向移动,A正确;催化剂同等程度改变正、逆反应速率,对平衡移动无影响,B不能用勒沙特列原理解释;合成氨反应中,把氨移出,减少生成物浓度,平衡向右移动,C正确;氯气溶于水的反应(Cl2+H2O H++Cl-+HClO)是可逆反应,饱和食盐水中氯离子浓度大,增大氯离子浓度,平衡向左移动,D正确。
H++Cl-+HClO)是可逆反应,饱和食盐水中氯离子浓度大,增大氯离子浓度,平衡向左移动,D正确。
点评:催化剂同等程度改变正、逆反应速率,对平衡移动无影响。
本题难度:一般
2、填空题 现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________热反应,且m+n______p (填“>”、“=”或“<”) 。
(2)减压时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同)
(3)若容积不变加入B,则A的转化率__________,B的转化率__________。
(4)若升高温度,则平衡时B、C的浓度之比将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量__________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________;而维持容器内压强不变,充入氖气时,混合物颜色?。(填“变深”、“变浅”或“不变”)
参考答案:(1)放 > (2)增大 (3)增大 减小 (4)减小 (5)不变 (6)变深 变浅
本题解析:(1)达到平衡后,当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应吸热,逆反应为放热反应。当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和,即m+n>p。
(2)减压平衡向逆反应方向移动,则A的质量分数增大。
(3)在反应容器中加入一定量的B,反应物B的浓度增大,平衡向正反应方向移动,则A的转化率增大,B加入的多,而转化的少,则B的转化率反而减小。
(4)正反应吸热,则升高温度平衡向正反应方向移动,B的物质的量减小,C的物质的量增多,所以二者的比值将减小。
(5)催化剂对化学平衡移动没有影响,所以若加入催化剂,平衡时气体混合物的总物质的量不变。
(6)若B是有色物质,A、C均无色,则加入C平衡向逆反应方向移动,B的浓度增大,则颜色加深。而维持容器内压强不变,充入氖气时,体积增大,对于反应体系来说,相当于减小压强,则平衡向逆反应方向移动,但移动的量远小于体积增大的因素,则B的浓度减小,颜色变浅。
本题难度:一般
3、选择题 在密闭容器内进行下列反应:X2(g)+Y2(g)? 2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,当反应在一定条件下达到平衡时各物质浓度可能是(? )
2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,当反应在一定条件下达到平衡时各物质浓度可能是(? )
A.Z为0.3mol·L-1
B.Y2为0.35mol·L-1
C.X2为0.2mol·L-1
D.Z为0.4mol·L-1
参考答案:AB
本题解析:用极限思想来判别问题,因反应是可逆的,所以物质浓度应在极限内,C、D项是两个极值。
本题难度:一般
4、选择题 关于化学反应2A(g) + B(g)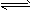 3C(g) + D(g),下列反应速率表示反应最快的是
3C(g) + D(g),下列反应速率表示反应最快的是
[? ]
A.v(A)=1.4mol·L-1·s-1
B.v(B)=0.6mol·L-1·s-1
C.v(C)=1.5mol·L-1·s-1
D.v(D)=1.6mol·L-1·min-1
参考答案:A
本题解析:
本题难度:简单
5、填空题 请回答下列问题:
(1)分别用浓、稀硝酸溶解等量的两份铜粉,消耗硝酸的物质的量较少的是____?硝酸(填“浓”或“稀”),相应的离子方程式是?。
(2) 800℃时,在2 L的恒容密闭容器中充入2 mol NO和1mol O2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
①5 min内 v(O2)=?。
②该条件下,2NO(g)+O2(g) 2NO2(g)的△H=?。
2NO2(g)的△H=?。
③若向平衡混合物中再充入NO、NO21mol,此时v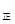 ?v
?v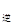 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
④若向平衡混合物中仅充入1mol NO2,平衡向____?(填“正向”、“逆向”或“不”)移动。达新平衡时,NO2的体积分数____?(填“增大”、“减小”或“不变”)。
(3)染料工业排放的废水中含有大量有毒的NO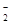 ,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____?。
,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____?。
参考答案:
(1)稀;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)①0.05 mol/(L·min)?②-2Q kJ/mol?③=?④逆向;增大
(3)2Al+NO2-+OH-+2H2O=2AlO2-+NH3·H2O
本题解析:
试题解析:(1)浓硝酸还原产物为NO2,稀硝酸还原产物为NO,转移电子数相同时,稀硝酸的用量少。
(2)①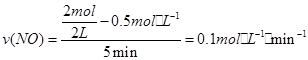 ,则v(O2)=0.05mol·L-1·min-1。
,则v(O2)=0.05mol·L-1·min-1。
②反应消耗NO:2mol-0.5mol/L×2L=1mol,放热QkJ,则消耗2molNO放热2QkJ。
③根据题中数据可知,平衡时NO、O2、NO2的物质的量浓度分别为0.5mol/L、0.25mol/L、0.5mol/L,则该温度下的平衡常数: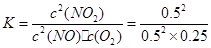 ?=4,加入NO、NO2各1mol,则NO、NO2浓度改变相同,因此Qc=K,平衡不移动,则正、逆反应速率相等。
?=4,加入NO、NO2各1mol,则NO、NO2浓度改变相同,因此Qc=K,平衡不移动,则正、逆反应速率相等。
④充入NO2则产物浓度增大,平衡逆向移动。因NO2浓度增大,因此平衡时其体积分数增大。
(3)根据加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出可知有氨水生成,则Al失电子,NO2-得电子,根据氧化还原反应电子得失守恒及电荷守恒,可写出化学方程式。
本题难度:一般