1、选择题 某元素X的气态氢化物的化学式为XH3,则下列叙述中不正确的是
[? ]
A.该元素原子的最外电子层上有5个电子
B.该元素最高价氧化物的化学式为X2O5
C.该元素在元素周期表中位于第VA族
D.该元素最高价氧化物对应的水化物的化学式为H2XO3
参考答案:D
本题解析:
本题难度:简单
2、推断题 A、B、C、D、E是原子序数依次增大的五种短周期元素。B、E同主族,且满足最高正化合价+最低负化合价=0;A与C、D与C之间都能形成原子个数比分别为2∶1和1∶1的两种化合物。试解答下列有关问题。
(1)在A2C2分子中含有的化学键是________和________。
(2)C与D形成的化合物的电子式为? ___________________________。
(3)实验室可用由B、C、D组成的化合物为反应物之一制取由A、C、D组成的化合物,反应的化学方程式为?_________________________________________。
(4)写出E单质与A、C、D形成的化合物的水溶液反应的离子方程式_________________________________________。
参考答案:(1)极性键;非极性键
(2) (或
(或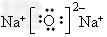 )
)
(3)Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
(4)Si+2OH-+H2O===SiO32-+2H2↑
本题解析:
本题难度:一般
3、选择题 A元素的最高正化合价和负化合价的绝对值之差6,B元素与A元素的原子次外层上的电子数均为8,A与B可形成化合物BA2,则该化合物是?
[? ]
A.MgCl2
B.CaF2
C.SiO2
D.CS2
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列结论不正确的是( )
A.微粒半径:S>S2->Cl->F
B.酸性:HClO4>H2SO4>H3PO4
C.氧化性:Cl2>S>Se>Te
D.离子还原性:S2->I->Br->OH-
参考答案:A、根据微粒半径大小比较的方法:电子层越多半径越大,所以F半径最小,电子层数一样,核电荷数越多半径越小,所以S2->Cl-,核电荷数一样,核外电子数越多,半径越大S<S2-,即S2->S>Cl->F,故A错误;
B、同周期从左到右,最高价氧化物对应水化物的酸的酸性逐渐增强,即HClO4>H2SO4>H3PO4,故B正确;
C、同周期从左到右单质的氧化性逐渐增强,所以氧化性:Cl2>S,同主族,从上到下,单质的氧化性逐渐减弱,所以S>Se>Te,即氧化性:Cl2>S>Se>Te,故C正确;
D、根据元素周期律,单质氧化性顺序是:Cl2>Br2>I2>S,所以离子还原性:S2->I->Br->OH-,故D正确.
故选A.
本题解析:
本题难度:简单
5、选择题 X、Y、Z、W四种主族元素,若X的阳离子与Y的阴离子具有相同的电子层结构;W的阳离子的氧化性强于等电荷数的X阳离子的氧化性;Z的阴离子半径大于等电荷数的Y的阴离子半径,则四种元素的原子序数由大到小的顺序是
[? ]
A. ZXYW
B. WXYZ
C. XYZW
D. ZYXW
参考答案:B
本题解析:
本题难度:一般