1、填空题 指出下列变化能量是怎样转化的:
(1)学校燃烧煤煮饭______(2)给手机的电池充电______
(3)用蓄电池点亮灯泡______.
参考答案:(1)学校燃烧煤煮饭将化学能转化为热能,故答案为:化学能转化为热能;
(2)给手机的电池充电将电能转化为化学能,故答案为:电能转化为化学能;
(3)用蓄电池点亮灯泡将化学能转化为电能,故答案为:化学能转化为电能.
本题解析:
本题难度:一般
2、填空题 直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。

(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,则甲醇燃烧的热化学方程式为 ? 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1="+49.0" kJ·mol-1
②CH3OH(g)+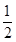 ?O2(g)= CO2(g)+2H2(g) △H2
?O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+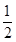 O2(g)=H2O(g) △H ="-241.8" kJ·mol-1
O2(g)=H2O(g) △H ="-241.8" kJ·mol-1
则反应②的△H2= kJ·mol-1。
(3)甲醇燃料电池的结构示意图如右。甲醇进入 极(填“正”或“负”),正极发生的电极反应式为 ? 。负极发生的电极反应式为 ? 。
参考答案:(1)CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.51kJ/mol?(2)-192.8
(3)负? O2+4H++4e-=2H2O? CH3OH+H2O-6e-=CO2↑+6H+
本题解析:(1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,则燃烧的热化学方程式为CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.51kJ/mol。
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0kJ/mol、③H2(g)+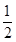 O2(g)=H2O(g) △H=-241.8 kJ/mol。则①+③得到反应②,即则△H2=+49.0kJ/mol+(-241.8kJ/mol)=-192.8kJ/mol。
O2(g)=H2O(g) △H=-241.8 kJ/mol。则①+③得到反应②,即则△H2=+49.0kJ/mol+(-241.8kJ/mol)=-192.8kJ/mol。
(3)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳,电极反应为CH3OH+H2O-6e-=CO2↑+6H+;氧气在正极通入,得到电子,电极反应式是O2+4H++4e-=2H2O。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,注重高考常考考点的考查,旨在培养学生分析、归纳和总结问题的能力。有利于调动学生的学习兴趣,激发学生的学习积极性。
本题难度:一般
3、填空题 (1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) =3CO2(g)+4H2O(l)?ΔH=-2220.0 kJ·mol-1
H2O(l)=H2O(g)?ΔH="+44.0" kJ·mol-1
则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为?。
(2)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)?ΔH=+140 kJ·mol-1
2C(s)+O2(g)="2CO(g)" ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:?。
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN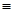 N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出??kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出??kJ能量。

(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2=2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将?能转化为?能。其电极反应式分别为:负极?,正极?。
参考答案:(1) 1022kJ?(2) TiO2(s)+2Cl2(g) +2C(s) ===TiCl4(l)+ 2CO(g) ?ΔH=-81 kJ·mol-
(3) 724kJ?(4)化学能?电能? 2H2-4e-=4H+? O2+4e-+4H+= 2H2O
本题解析:(1)已知①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)?ΔH=-2220.0 kJ·mol-1,②H2O(l)=H2O(g)?ΔH="+44.0" kJ·mol-1,则根据盖斯定律可知①+②×4即得到C3H8(g)+5O2(g)=3CO2(g)+4H2O(g)?ΔH=-2044kJ·mol-1,则0.5mol丙烷燃烧生成CO2和气态水时释放的热量为2044kJ·mol-1×0.5mol=1022kJ。
(2)已知:③TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)?ΔH=+140 kJ·mol-1,④2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则根据盖斯定律可知③+④即得到TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式为TiO2(s)+2Cl2(g) +2C(s) ===TiCl4(l)+ 2CO(g) ?ΔH=-81 kJ·mol-。
(3)在N4=2N2反应中,根据反应热等于反应物总键能减去生成物总键能可知,1molN4气体转化为N2的吸收或放出的热量为:6×193kJ-2×941kJ=-724kJ,即该反应放出724kJ热量。
(4)该电池属于原电池,是将化学能转变为电能的装置,该反应中氢气失电子被氧化,氢气失电子生成氢离子,所以电极反应式为2H2-4e-═4H+,氧气得电子被还原,氧气得电子和溶液中的氢离子生成水,所以电极反应式为O2+4H++4e-═2H2O。
本题难度:一般
4、填空题 (12分)工业上合成甲醇一般采用下列反应: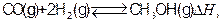 下表是该反应在不同温度下的化学平衡常数(K):
下表是该反应在不同温度下的化学平衡常数(K):
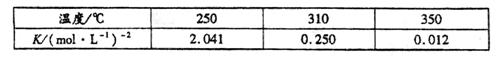
(1)由表中数据判断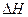 ?0(填“>”、“=”或“<”)。
?0(填“>”、“=”或“<”)。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol·L-1,则此时的温度为?℃。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:

①反应从2min到4min之间,H2的反应速率为?。
②反应达到平衡时CO的转化率为?。
③反应在第2min时改变了反应条件,改变的条件可能是?(填序号)。
a.使用催化剂? b.降低温度? c.增加H2的浓度
(4)常温常压 下:
下:
①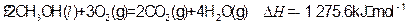
②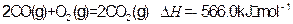
③
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
?
(5)一种甲醇燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧化作用生成水和二氧化碳。该电池的负极反应式为:?。
若以上述燃料电池为电源来电解饱和食盐水,当消耗32g甲醇时,电解产生的H2体积(标况)为??L。
参考答案:(12分)
(1)<(1分)?(2)310(1分)
(3)①0.3mol·L-1 min-1(2分无单位扣1分)?②62.5%(2分)?③a?(1分)
(4)CH3OH(l)+O2(g)=CO(g)+2H2O(l)?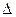 H=-442.8kJ·mol-1 (2分)
H=-442.8kJ·mol-1 (2分)
(5)CH3OH+H2O=CO2+6H++6e-(2分)? 67.2(1分)
本题解析:略
本题难度:一般
5、选择题 已知H—H键能为436 kJ·mol-1,N—H键能为391 kJ·mol-1,根据化学方程式:N2(g)+3H2(g) 2NH3(g) ΔH="-92.4" kJ·mol-1,则N≡N键的键能是( )
2NH3(g) ΔH="-92.4" kJ·mol-1,则N≡N键的键能是( )
A.431 kJ·mol-1
B.946 kJ·mol-1
C.649 kJ·mol-1
D.896 kJ·mol-1
参考答案:B
本题解析:化学反应的本质是反应物分子旧键断裂(吸收能量),生成物分子新键形成(放出能量),反应热等于反应物的键能之和减去生成物的键能之和。
设N≡N的键能为E(N≡N),则有
1 mol×E(N≡N)+3 mol×436 kJ·mol-1-2 mol×3×391 kJ·mol-1="-92.4" kJ·mol-1
解得E(N≡N)≈946 kJ·mol-1。
本题难度:一般