1、选择题 最近,兰州近代物理研究所研制出我国首批氧-18气体。氧-18是氧的一种同位素,称为重氧,下列说法正确的是
[? ]
A.1.8g氧-18气体的物质的量是0.1mol
B.0.1mol重氧气体的体积是2.24L
C.重氧气体的摩尔质量为36g
D.0.1mol重氧水所含中子数约是6.02×1023个
参考答案:D
本题解析:
本题难度:简单
2、选择题 某溶液经分析只含有Na+、K+、Ca2+、Cl-、NO
,已知其中Na+、K+、Ca2+、NO的浓度均为0.2mol?L-1,则Cl-的物质的量浓度为( )
A.0.6mol?L-1
B.0.5mol?L-1
C.0.4mol?L-1
D.0.3mol?L-1
参考答案:溶液呈电中性,则溶液中阴阳离子所带电荷总数相等,
所以c(Na+)+c(K+)+2c(Ca2+)=c(Cl-)+c(NO3-),
即0.2mol/L+0.2mol/L+2×0.2mol/L=c(Cl-)+0.2mol/L,
所以c(Cl-)=0.6mol/L,
故选A.
本题解析:
本题难度:简单
3、选择题 某结晶水合物的化学式为R·nH2O,其相对分子质量为M。25℃时,将ag该晶体溶于b g水中恰好可形成V mL饱和溶液。下列关系中正确的是
[? ]
A.饱和溶液的物质的量浓度为c=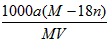 mol·L-1
mol·L-1
B.饱和溶液中溶质的质量分数为
C.25 ℃时R的溶解度为
D.饱和溶液的密度为
参考答案:C
本题解析:
本题难度:一般
4、填空题 (4分)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(标准状况)。则产物中硝酸铜的物质的量为?。如原混合物中有0.0lmolCu,则其中Cu2O与CuO的质量比为___________。
参考答案:(1)0.025(2)9:5
本题解析:(1)硝酸具有强氧化性,将Cu2O氧化生成硝酸铜、一氧化氮和水,配平据此写出反应方程式;利用N原子守恒进行计算;(2)利用N原子守恒、电子守恒和铜原子守恒进行计算,n(HNO3)=0.1L×6mol/L=0.6mol,n(NO)=
2.24L
22.4L/mol
所以n(NO)=0.1mol,
利用N原子守恒可知n[Cu(NO3)2]=
0.6mol-0.1mol
2
=0.025mol,
(3)由Cu元素守恒可得:2×n(Cu20)+n(CuO)+0.1mol=0.25mol,
由氧化还原反应得失电子守恒可知:0.1×2+2×n(Cu20)=
2.24L
22.4L/mol
×3,
解之得:n(Cu20)=0.05mol,n(CuO)=0.05mol,所以:m(Cu20): n(CuO)=9:5
点评:本题难度中下,关键在于硝酸的强氧化性的相关计算和原子守恒、电子守恒。
本题难度:一般
5、选择题 实验指出,无水氯化铝在常压条件下存在的形式常为AlCl3和Al2Cl6两种分子。已知无水氯化铝在不同温度 时的密度数据如下表

可见,600℃时无水氯化铝存在形式的化学式为
[? ]
A.AlCl3
B.Al3Cl6
C.AlCl3和Al2Cl6
D.Al3Cl9
参考答案:C
本题解析:
本题难度:一般