| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学平衡》高频考点特训(2017年练习版)(十)
参考答案: 本题解析: 本题难度:一般 2、填空题 (共12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。 |
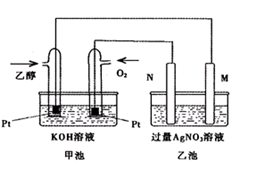
参考答案:(14分)
Ⅰ:(1) 0.225 (2) 75% (3) C
Ⅱ:(1) 铁 (2)C2H5OH-12e+16OH—=2CO32—+11H2O
(3) 1 (4)C2H5OH(l)+3O2(g) 2CO2(g)+3H2O(l) △H=-1366.7kJ/mol
本题解析:Ⅰ.(1)①v(CO2)= 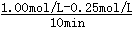 =0.075mol/(L?min),则v(H2)=3×v(CO2)=0.225mol/(L?min),故答案为:0.225;
=0.075mol/(L?min),则v(H2)=3×v(CO2)=0.225mol/(L?min),故答案为:0.225;
(2)由(1)得知,CO2反应了0.75mol,所以CO2的转化率等于0.75mol*100%/1mol=75%;
(3)使n(CH3OH)/n(CO2)增大应使平衡向正反应方向移动:
A.该反应正反应为放热反应,则升高温度平衡向逆反应方向移动,故A错误;
B.充入He气,参加反应的物质的浓度不变,平衡不移动,故B错误;
C.将H2O(g)从体系中分离,生成物浓度减小,平衡向正反应方向移动,故C正确;
D.使用催化剂只能加快反应速率,不能使化学平衡移动,故D错误。
故答案为:C。
Ⅱ.(1)作时M、N两个电极的质量都不减少,M为阴极得到电子,N为阳极是失电子的,综合分析,M极的电极材料为铁。
(2)加入乙醇的电极是负极,失去电子,电极反应式为C2H5OH-12e+16OH—=2CO32—+11H2O。
(3)发生的反应为:
阴极反应:4Ag+ 4e- ==4Ag
阳极反应:4OH- +4e- ==2H2O+O2↑
总反应:4AgNO3 + 2H2O ==4HNO3 + 4Ag+ O2↑
N(Ag)=4.32g/108(g/mol)=0.04mol,n(HNO3)=0.04mol,即n(H+)=0.04mol,c(H+)=0.04mol/0.4L=0.1mol/L,PH=1。
考点:物质的量或浓度随时间的变化曲线 原电池和电解池的工作原理 化学平衡常数的含义 化学平衡的影响因素
点评:本题考查较为综合,涉及反应速率、平衡常数、平衡移动以及电化学等知识,题目难度不大,注意把握影响平衡移动的因素以及平衡移动方向的判断。
本题难度:一般
3、选择题 将等物质的量的F2和ClF混合,在密闭容器中发生反应: F2(g)+ClF(g)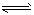 ClF3(g);△H<0。下列叙述中,正确的是
ClF3(g);△H<0。下列叙述中,正确的是
[? ]
A.恒温恒容时,当ClF 转化40% 时,容器内的压强为初始时的0.8 倍
B.若 c(F2):c (ClF): c (ClF3) =1: 1: 1, 则反应一定达到平衡状态
C.达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移
D.平衡后再降低温度,保持恒容,达到新的平衡,则混合气体的平均摩尔质量增大
参考答案:AD
本题解析:
本题难度:一般
4、选择题 密闭容器中的平衡体系H2+I2(g)  2HI(g) △H < O,欲使HI浓度增大,可采取的措施是
2HI(g) △H < O,欲使HI浓度增大,可采取的措施是
A.扩大体积
B.升温
C.降温
D.加催化剂
参考答案:C
本题解析:从化学平衡角度看应选C,但题目要求HI浓度增大,缩小体积而使体系压强增大,化学平衡虽然不移动,但HI浓度会增大。
考点:化学平衡
本题难度:一般
5、填空题 (1)在固定体积的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)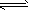 CO2(g)十H2(g) △H<0 此反应的平衡常数表达式K = ____________该温度下,根据下图计算此反应的平衡常数K =___________。升高温度后K值将__________(填“增大、减小或不变”)
CO2(g)十H2(g) △H<0 此反应的平衡常数表达式K = ____________该温度下,根据下图计算此反应的平衡常数K =___________。升高温度后K值将__________(填“增大、减小或不变”) 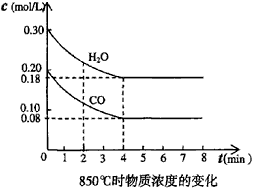
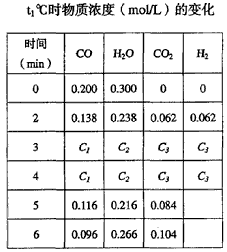
参考答案:(1)K=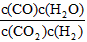 ;K=1;减小
;K=1;减小
(2)①平衡;>;②b;c
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《物质的量》.. | |