1、选择题 能在水溶液中大量共存的离子组是
A.H+、Fe3+、ClO-、Cl-
B.H+、NH4+、Fe2+、NO3-
C.Ag+、K+、Cl-、SO42-
D.K+、AlO2-、Cl-、OH-
参考答案:D
本题解析:H+与ClO-结合为难电离的HClO,故A项错误;Fe2+被NO3-、H+氧化为Fe3+,故B项错误;Ag+与Cl-、SO42-结合为难溶解的AgCl、Ag2SO4,故C项错误;K+、AlO2-、Cl-、OH-之间不能结合成沉淀、气体或水,也没有电子转移,故D项正确。
本题难度:一般
2、选择题 常温下,下列叙述错误的是
A.向0.1mol·L-1的醋酸溶液中加水或通入HCl气体都能使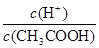 值增大
值增大
B.0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7
D.0.1mol·L-1某一元酸HA溶液中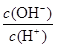 =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L
=1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol/L
参考答案:B
本题解析:A、醋酸是弱酸,存在电离平衡CH3COOH CH3COO-+H+。加入稀释促进醋酸的电离,氢离子的物质的量增加,醋酸的物质的量减少,所以
CH3COO-+H+。加入稀释促进醋酸的电离,氢离子的物质的量增加,醋酸的物质的量减少,所以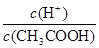 值增大。通入氯化氢气体,增大氢离子的浓度,抑制醋酸的电离,但氢离子增大的倍数大于醋酸增大的倍数,所以
值增大。通入氯化氢气体,增大氢离子的浓度,抑制醋酸的电离,但氢离子增大的倍数大于醋酸增大的倍数,所以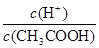 值增大,A正确;B、0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后生成醋酸和氯化钠,醋酸钠过量,且三种物质的物质的量相等。由于溶液显酸性,即c(H+)>c(OH-),这说明醋酸的电离程度大于CH3COO-的水解程度,所以c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),B不正确;C、醋酸是弱酸,存在电离平衡,则.pH=4的醋酸的浓度大于1×10-4mol/L,所以与pH=10的氢氧化钠溶液等体积混合醋酸过量,溶液的pH<7,C正确;D、0.1mol·L-1某一元酸HA溶液中
值增大,A正确;B、0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后生成醋酸和氯化钠,醋酸钠过量,且三种物质的物质的量相等。由于溶液显酸性,即c(H+)>c(OH-),这说明醋酸的电离程度大于CH3COO-的水解程度,所以c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),B不正确;C、醋酸是弱酸,存在电离平衡,则.pH=4的醋酸的浓度大于1×10-4mol/L,所以与pH=10的氢氧化钠溶液等体积混合醋酸过量,溶液的pH<7,C正确;D、0.1mol·L-1某一元酸HA溶液中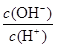 =1×10-8,则根据水的离子积常数可知,溶液中c(OH-)=
=1×10-8,则根据水的离子积常数可知,溶液中c(OH-)=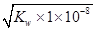 =1×10-11mol/L,因此溶液中由水电离出的c(H+)=1×10-11mol/L,D正确,答案选B。
=1×10-11mol/L,因此溶液中由水电离出的c(H+)=1×10-11mol/L,D正确,答案选B。
本题难度:一般
3、选择题 下列说法不正确的(?)
A.K+、Na+、NO3-、CO32-在碱性溶液中能大量共存
B.Na+、K+、OH-、Cl-在强酸性溶液中能大量共存
C.Cu2+、H+、NO3-、SO42-能 形成无色透明的溶液
形成无色透明的溶液
D.Ba2+、Na+、Cl-、S O42-?在溶液中不能大量共存
O42-?在溶液中不能大量共存
参考答案:BC
本题解析:略
本题难度:一般
4、选择题 在强碱性的无色溶液中,可以大量共存的一组离子是
[? ]
A.NH4+、NO3-、K+、SO42-
B.CO32-、NO3-、HCO3-、Na+
C.Na+、K+、CO32-、 NO3-
D.MnO4-、K+、Na+、SO42-
参考答案:C
本题解析:
本题难度:一般
5、选择题 某溶液中存在五种离子:NO3-、SO42-、Fe3+、H+和R离子,其物质的量之比为2:3:1:3:1,则R可能为?(?)
A.Fe2+
B.Mg2+
C.C1-
D.Ba2+
参考答案:B
本题解析:略
本题难度:简单