1、选择题 下列粒子中,与NH4+具有相同质子数和电子数的是
A.OH—
B.F-
C.Na+
D.NH3
参考答案:C
本题解析:NH4+的质子数和电子数分别是11、10。A、OH—的质子数和电子数分别是9、10,不相同,错误;B、F-的质子数和电子数分别是9、10,不相同,错误;C、Na+的质子数和电子数分别是11、10,正确;D、NH3的质子数和电子数分别是10、10,不相同,错误,答案选C。
本题难度:一般
2、选择题 同周期的X、Y、Z三元素,其最高价氧化物对应水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是
A.原子半径:X>Y>Z
B.非金属性:X>Y>Z
C.原子序数按X、Y、Z的顺序由小到大
D.气态氢化物的稳定性按X、Y、Z的顺序由强到弱
参考答案:BD
本题解析:在同一周期的元素由左到右原子序数递增,原子半径递减,金属性减弱,非金属性增强;其最高价氧化物对应水化物的酸性由弱到强,气态氢化物的稳定性按X、Y、Z的顺序由强到弱。
本题难度:一般
3、选择题 同族元素所形成的同一类型的化合物,其 结构和性质往往相似。化合物PH4I是一种白色晶体
结构和性质往往相似。化合物PH4I是一种白色晶体 ,下列对它的描述中正确的是
,下列对它的描述中正确的是
A.它是一种共价化合物
B.在加热时此化合物不能分解为PH3和HI
C.这种化合物不能跟碱反应
D.该化合物可以由PH3和 HI化合而成
HI化合而成
参考答案:D
本题解析:略
本题难度:一般
4、选择题 X元素原子的质量数为m,核内中子数为n,则Wg X2+ 离子含有的电子的物质的量约为( )
A.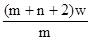 mol
mol
B.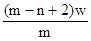 mol
mol
C.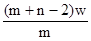 mol
mol
D.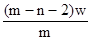 mol
mol
参考答案:D
本题解析:X元素的原子序数是m-n,则X2+ 离子的电子数是m-n-2。所以Wg X2+ 离子含有的电子的物质的量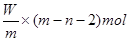 ,所以答案是D。
,所以答案是D。
本题难度:一般
5、选择题 X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大。X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层电子数与其电子层数相等,Z—与M2+具有相同的核外电子层结构。下列推测正确的是?(?)
A.原子半径Y>Z,离子半径Z—<M2+
B.MX2与水发生反应时,MX2只做氧化剂
C.X、Y形成的化合物既能与强酸反应又能与强碱反应
D.MX2、MZ2两种化合物中,都含有离子键和共价键,且阳离子与阴离子个数比均为1:2
参考答案:C
本题解析:根据题意可知:X是O;Y是Al;Z是Cl;M是Ca。A.Al、Cl是同一周期的元素,原子序数越大,原子半径就越小,所以原子半径Al>Cl;Cl-、Ca2+是电子层结构相同的微粒。原子序数越大,离子半径就越小。所以离子半径Cl—>Ca2+.错误。B.在2CaO2+2H2O=2Ca(OH)2+ O2↑中CaO2做氧化剂、还原剂。错误。C. Al2O3是两性氧化物,既能与酸反应产生盐和水,也能与碱反应产生盐和水。正确。D.在CaO2中含有离子键、非极性共价键,阳离子与阴离子个数比1:1;而在CaCl2中含有离子键, 阳离子与阴离子个数比1:2;错误。
本题难度:简单