1、实验题 苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛。
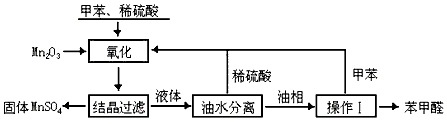
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是____________。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离。该过程中需将混合物冷却,其目的是______________________。
(3)实验过程中,可循环使用的物质分别为__________、__________。
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ是___________,其原理是___________。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表)。
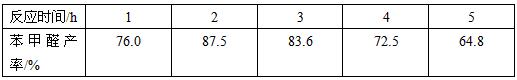
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因___________。
参考答案:(1)使反应物充分接触,增大反应速率
(2)降低MnSO4的溶解度
(3)稀硫酸;甲苯
(4)蒸馏;利用甲苯和苯甲醛的沸点差异使二者分离
(5)部分苯甲醛被氧化成苯甲酸
本题解析:
本题难度:一般
2、实验题 我国著名化学家侯德榜生先发明的“侯氏制碱法”,因原料利用率高,并能进行连续生产,从而享誉海内外。“侯氏制碱法”的原理是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得的碳酸氢钠晶体加热分解后即 可得到纯碱。它的反应原理可用下列化学方程式表示:
NaCl(饱和)+NH3+CO2+H2O===NaHCO3↓+NH4Cl;2NaHCO3 Na2CO3+CO2↑+H2O。某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如图所示的一套实验装置:
Na2CO3+CO2↑+H2O。某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如图所示的一套实验装置:
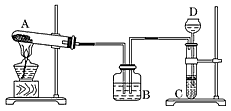
实验室可供选用的药品有:浓氨水、纯碱、大理石、稀盐酸、稀硫酸、熟石灰、氯化氨、氯化钠。
(1)A、D中最合适的试剂为:A________;D________(填名称)。
(2)本实验具体操作过程中,应先通入________气体,再通入________气体;原因是_________________________________________________________________。
(3)指出该装置中的错误(至少两处)__________________________________________ 。
(4)在改进装置中,该兴趣小组同学进行了实验,实验所用的饱和NaCl溶液中含溶质58.5 g,实验最后得到无水碳酸钠26.0 g,则其产率为________;该兴趣小组同学针对其实验结果,认真分析了造成损失的原因,发现其操作步骤并没有错误,则主要原因是_______________________________________________。
(5)在“侯氏制碱法”工业生产中,原料的利用率高,大大降低了成本.请问本实验中哪些物质可重复利用?____________。
参考答案:(1)氯化铵和熟石灰;稀盐酸
(2)NH3;CO2;CO2在水中溶解度小,先通入NH3至饱和,有利于NaHCO3析出
(3)B、C之间缺少止水夹;B装置应与大气相通,不能为密闭装置;通NH3的导管不应伸入液面以下(任填两种即可)
(4)49.0%;NaHCO3在水中有较大的溶解度,未能全部沉淀
(5)NH4Cl、CO2
本题解析:
本题难度:一般
3、填空题 氟化钠的用途非常广泛,可作杀菌剂、杀虫剂和木材防腐剂。实验室可通过下图所示的流程来制取
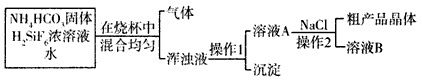
请结合每小题的相关信息,回答下列有关问题:
(1)已知:饱和氟硅酸(H2SiF6)溶液为无色透明的发烟液体,密度为1.32 g/mL,易挥发,有刺激性气味,与等物质的量浓度的H2SO4酸性相当,它对玻璃、陶瓷都有较强的腐蚀性。以上实验所用仪器全部用聚酯类材料(如: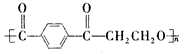 )做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和水时,加入试剂的顺序应是________________ ,加好试剂后,为了让它们充分反应,不能用
)做成,在该类材料做成的容器中混合NH4HCO3固体、H2SiF6浓溶液和水时,加入试剂的顺序应是________________ ,加好试剂后,为了让它们充分反应,不能用
_______ 棒搅拌(填字母)。
A.玻璃 B.铁 C.聚乳酸 D.陶瓷
(2)已知在20℃时Na2SiF6的溶解度为2.12 g,请写出1 L 1 mol/L的H2SiF6溶液与1 L 1 mol/LNa2CO3溶液混合后(假设混合液中水的质量约等于2000 g)发生化学反应的离子方程式为__________________。
(3)上述流程图中产生浑浊液的原因是生成了___(填字母)。
A.NH4F B.H2SiO3 C.(NH4)2SiF6 D.(NH4)2CO3
(4)操作1后是否需要对沉淀进行洗涤?____(填“是”或“否”),原因是__________________。
(5)溶液B中经操作________________(填操作名称,下同)可得到副产品氯化铵;粗产品晶体经______可得纯净的产品。
参考答案:(1)NH4HCO3固体、水和H2SiF6浓溶液;ABD
(2)2H++SiF62-+2Na++CO32-=Na2SiF6↓+CO2↑+H2O
(3)B
(4)是;使NH4F(沉淀表面吸附的)全部转移到溶液A中(或提高产品产率等说法均可)
(5)蒸发(浓缩)、(冷却)结晶;重结晶
本题解析:
本题难度:一般
4、实验题 ?Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程为:________。为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入___________。
(2)除去蒸馏水中溶解的O2常采用_________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4 溶液液面下,再挤出NaOH溶液,这样操作的理由是________________。
(4)检验Fe3+存在的最佳试剂是___________?,现象是_____________。
(5)写出Fe与H2O在一定条件下反应的化学方程式___________。
参考答案:4Fe(OH)2+O2+2H2O?=?4Fe(OH)3?
(1)铁粉?
(2)加热至沸腾?
(3)防止空气随着NaOH溶液的加入进入溶液?
(4)KSCN溶液 ;溶液变为血红色
(5)3Fe?+?4H2O(g) ?Fe3O4?+?4H2
?Fe3O4?+?4H2
本题解析:
本题难度:一般
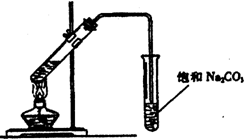
5、简答题 实验室用如图所示装置制取乙酸乙酯.
(1)装置中通有蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是:______;
(2)饱和Na2CO3溶液的作用是:______;
(3)实验生成的乙酸乙酯,其密度比水______.(填“大”或“小”);
(4)分离乙酸乙酯和饱和Na2CO3溶液所需要的主要仪器是:______.
参考答案:(1)导管若插入溶液中,反应过程中可能发生倒吸现象,所以导管要插在饱和碳酸钠溶液的液面上,目的是防止倒吸,
故答案为:防止倒吸;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:除去乙酸乙酯中的少量乙酸和乙醇,降低乙酸乙酯的溶解度;
(3)乙酸乙酯的密度小于水的密度,会浮在混合液的上层,
故答案为:小;
(4)乙酸乙酯不溶于饱和碳酸钠溶液,振荡后混合液分层,可以通过分液操作分离出乙酸乙酯,分液操作使用的主要仪器为分液漏斗,
故答案为:分液漏斗.
本题解析:
本题难度:一般