1、选择题 下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快的是
[? ]
A.v(H2)==0.1 mol/(L·min)
B.v(N2)==0.1mol/(L·min)
C.v(NH3)==0.15mol/(L·min)
D.v(N2)==0.002mol/(L·s)
参考答案:D
本题解析:
本题难度:简单
2、填空题 (10分)痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:①HUr(尿酸,aq) Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka=4.0×10—6)?②NaUr(s)
Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka=4.0×10—6)?②NaUr(s)  Ur-(aq)+Na+(aq)
Ur-(aq)+Na+(aq)
(1)37°时,1.0 L水中可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为________。
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp________(填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是________(填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol·L—1,其中尿酸分子的浓度为5.0×10—4mol·L—1,该病人尿液的c(H+)为??,PH?7(填“>”、“=”或“<”)。
参考答案:(共10分)
(1)6.4×10-5 ? (2)减小 放热? (3)1.33×10-6 mol·L-1 <
本题解析:略
本题难度:简单
3、选择题 在一定温度下,向a L密闭容器中加入1 mol X和2mol Y,发生如下反应:X(s) + 2Y(g)
 2Z(g) ,此反应达到平衡的标志是
2Z(g) ,此反应达到平衡的标志是
A.容器内压强不随时间变化
B.容器内X、Y、Z的浓度之比为l : 2 : 2
C.容器内各物质的浓度不随时间变化
D.单位时间消耗0.1 mol X同时生成0.2 mol Z
参考答案:C
本题解析:略
本题难度:一般
4、填空题 (12分)在一定温度下的2 L密闭容器中充入0.4 mol SO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g)  2SO3(g)? ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g)? ΔH <0,n(O2)随时间的变化如图实线所示:

(1)用SO2表示0~4 min内该反应的平均速率为?。该温度下反应的平衡常数K为?。升高温度K值??(填“增大”、“不变”或“减小”)。?
(2)若温度不变,在容器中再加1 mol O2 ,重新达到平衡,则SO2的平衡浓度?
(填“增大”、“不变”或“减小”),氧气的转化率?(填“升高”、“不变”或“降低”),SO3的体积分数?(填“增大”、“不变”或“减小”)。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_____________________________,曲线II对应的实验条件改变是______________________________________。
参考答案:(1)0.025 mol/(L·min)(2分)? 20(2分)?减小(1分)
(2)减小(1分)?降低(1分)?减小(1分)
(3)升高温度(2分)?增大压强(2分)
本题解析:(1)化学反应速率通常用单位时间内浓度的变化量来表示。0~4 min内氧气减少了0.1mol,则同时消耗二氧化硫是0.2mol,所以用SO2表示0~4 min内该反应的平均速率为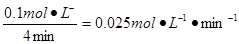 。平衡是容器内氧气、二氧化硫、三氧化硫的浓度分别是0.05mol/L、0.1mol/L、0.1mol/L,所以平衡常数是
。平衡是容器内氧气、二氧化硫、三氧化硫的浓度分别是0.05mol/L、0.1mol/L、0.1mol/L,所以平衡常数是 。因为反应是放热反应,所以温度升高平衡向逆反应方向移动,即平衡常数减小。
。因为反应是放热反应,所以温度升高平衡向逆反应方向移动,即平衡常数减小。
(2)再加入1mol氧气,氧气浓度增大,平衡向正反应方向移动,提高二氧化硫的转化率,所以SO2的平衡浓度将减小,但氧气的转化率将减小。根据(1)可计算出平衡时二氧化硫的体积分数是40%。通入1mol氧气,若二氧化硫全部生成三氧化硫才是0.4mol,此时其体积分数是2/7,所以其体积分数减小。
(3)曲线I和原来相比,达到平衡的时间少了,但氧气的转化率降低了,所以只能是升高温度。曲线Ⅱ和原来相比,达到平衡的时间也少了,但氧气的转化率增大了,所以只能是增大压强。
本题难度:简单
5、选择题 在一定的条件下,将10molH2和1molN2充入一密闭容器中,在适当条件下使其发生反应:N2+3H2?2NH3,达到平衡后.则H2的转化率可能是( )
A.35%
B.30%
C.25%
D.75%
参考答案:假定1mol氮气完全反应,由方程式N2+3H2?2NH3可知,参加反应的氢气的物质的量为1mol×3=3mol,
故氢气转化率的极大值为:3mol10mol×100%=30%,
由于反应是可逆反应,氮气不能完全反应,故氢气的实际转化率小于30%,
故选C.
本题解析:
本题难度:一般