1、选择题 体积相同的密闭容器中均充入1 mol X和1mol Y,分别于300℃和500℃开始发生反应: X(g)+Y(g) 3Z(g),Z的含量(Z%)随时间t的变化如下图所示。
3Z(g),Z的含量(Z%)随时间t的变化如下图所示。

已知在t3时刻改变曲线b某一实验条件,下列判断正确的是
A.曲线a是500℃时的图像
B.从0到t1时刻,反应物X(g)的
C.t2时刻生成物Z的量
D.t3时刻改变的条件可能是降温
参考答案:D
本题解析:A、反应开始时b曲线的反应速率快,所以b的温度高,曲线b是500℃时的图像,错误;B、从0到t1时刻,b反应速率大于a,所以v(500 ?C)> v(300 ?C),错误;C、t2时刻生成物Z的量相同,所以△n(300 ?C)=△n(500 ?C),错误;D、从a到b,升高温度,Z的含量减小,说明升温,平衡逆向移动,正向是放热反应。t3时刻Z的含量增加,说明平衡正向移动,可能为降温或减小压强,正确,答案选 D。
本题难度:一般
2、选择题 将2.0mol?SO2气体和2.0mol?SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)?2SO3(g),达到平衡时SO3为n?mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n?mol的是( )
A.1.6?mol?SO2+0.3?mol?O2+0.4?mol?SO3
B.4.0?mol?SO2+1.0?mol?O2
C.2.0?mol?SO2+1.0?mol?O2+2.0?mol?SO3
D.3.0?mol?SO2+0.5?mol?O2+1.0?mol?SO3
参考答案:开始投入2.0mol?SO2气体和2.0mol?SO3气体,等效为开始投入4.0mol?SO2气体和1mol?O2气体,在恒温恒容下,平衡时SO3的物质的量不变为n?mol,说明应是完全等效平衡,按化学计量转化到左边,对应成分的物质的量相同,即满足4.0mol?SO2气体和1mol?O2气体.
A、开始为1.6?mol?SO2+0.3?mol?O2+0.4?mol?SO3,转化到左边,由2SO2(g)+O2(g)?2SO3(g)可知,n(SO2)=1.6mol+0.4?mol=2mol,n(O2)=0.3mol+12×0.4mol=0.5mol,不满足4.0mol?SO2气体和1mol?O2气体,故A错误;
B、开始为4.0?mol?SO2+1.0?mol?O2,与原平衡等效,故B正确;
C、开始为2.0?mol?SO2+1.0?mol?O2+2.0?mol?SO3,转化到左边,由2SO2(g)+O2(g)?2SO3(g)可知,n(SO2)=2mol+2?mol=4mol,n(O2)=1mol+12×2mol=2mol,不满足4.0molSO2气体和1molO2气体,故C错误;
D、开始为3.0?mol?SO2+0.5?mol?O2+1.0?mol?SO3,转化到左边,由2SO2(g)+O2(g)?2SO3(g)可知,n(SO2)=3mol+1?mol=4mol,n(O2)=0.5mol+12×1mol=1mol,满足4.0molSO2气体和1molO2气体,故D正确.
故选BD.
本题解析:
本题难度:简单
3、选择题 增大压强能使下列化学反应的平衡向正反应方向移动的是(?)。
A.C(s)+CO2(g) 2CO(g)
2CO(g)
B.3H2(g)+N2(g) 2NH3(g)
2NH3(g)
C.H2(g)+I2(g) 2HI(g)
2HI(g)
D.C(s)+H2O(g) CO(g) + H2(g)
CO(g) + H2(g)
参考答案:B
本题解析:要使增大压强,化学反应向正反应方向移动,即正反应方向为气体体积减少的方向移动,所以正确选项为B;
本题难度:简单
4、选择题 下列事实不能用勒夏特列原理解释的是( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加CaCO3后,溶液漂白性增强
D.在硫化氢水溶液中加入碱有利于S2-
参考答案:B
本题解析:勒夏特列原理是指:如果改变影响平衡的条件之一(如浓度、温度、压强),平衡将会向着能够减弱这种改变的方向上移动;
A可以,啤酒中存在平衡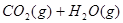 ?
?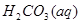 开启瓶盖后,压强减小,平衡将向逆反应方向移动;B错,反应存在平衡
开启瓶盖后,压强减小,平衡将向逆反应方向移动;B错,反应存在平衡 ?
? 加压,碘蒸气浓度增大,颜色加深;但平衡不移动;C可以,氯水中存在平衡
加压,碘蒸气浓度增大,颜色加深;但平衡不移动;C可以,氯水中存在平衡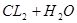 ?
?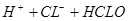 ,加碳酸钙后,会与溶液中的氢离子反应,使平衡向正反应方向移动,溶液中的HCLO溶液增大,漂白性增强;D正确,硫化氢溶液中有平衡:
,加碳酸钙后,会与溶液中的氢离子反应,使平衡向正反应方向移动,溶液中的HCLO溶液增大,漂白性增强;D正确,硫化氢溶液中有平衡: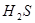 ?
?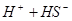 ,加碱,中和氢离子,使硫化氢的向电离方向移动生成更多的硫离子;
,加碱,中和氢离子,使硫化氢的向电离方向移动生成更多的硫离子;
本题难度:一般
5、选择题 2SO2(g)+O2(g) 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
?
| 甲
| 乙
| 丙
|
起始物质的量
| n(SO2) / mol
| 0.4
| 0.8
| 0.8
|
n(O2) / mol
| 0.24
| 0.24
| 0.48
|
SO2的平衡转化率 / %
| 80
| α1
| α2
|
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.该温度下,平衡常数值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率大于乙中O2的转化率
参考答案:B
本题解析:A.温度相同时,该反应的平衡常数不变,则甲、乙中反应的平衡常数相等,故A错误;
B.根据2SO2(g)+O2(g) 2SO3(g),
2SO3(g),
开始 0.4 0.24 0
转化 0.32 0.16 0.32
平衡 0.08 0.08 0.32
平衡浓度0.04 0.04 0.16
所以该温度下,平衡常数值为(0.16mol/L)2/[(0.04ol/L)2×0.04mol/L] =400,故B正确;
C.体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大,即丙中c(SO3)大于甲中c(SO3)的2倍,故C错误;
D.由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,则乙中O2的转化率大于甲中O2的转化率,故D错误;
故选B。
点评:本题考查化学平衡的计算,熟悉化学平衡的三段法计算及影响平衡移动的因素即可解答,注意平衡常数只与温度有关,计算平衡常数应利用平衡浓度,题目难度中等。
本题难度:一般