1、选择题 共价键的断裂有均裂和异裂两种方式,即均裂: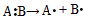 ,异裂:
,异裂: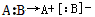 。下列化学反应中发生共价键均裂的是
。下列化学反应中发生共价键均裂的是
[? ]
A. 2K+2H2O=2KOH+H2↑
B. 2Na+2C2H5OH→2C2H5ONa+H2↑
C.?Na2CO3+ H2O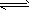 NaHCO3 + NaOH
NaHCO3 + NaOH
D. CH3COOH +C2H5OH H2O+CH3COOC2H5
H2O+CH3COOC2H5
参考答案:D
本题解析:
本题难度:简单
2、选择题 根据元素周期律和周期表,下列各项叙述正确的组合是:①同一主族元素,原子半径越大,非金属单质的熔点一定越高;②同一周期元素的原子(除稀有气体),半径越大越容易失去电子;③若R2-和M+的电子层结构相同,则微粒半径:M+>R2-;④原子半径X小于Y的同一主族的两种元素,若X(OH)n是强碱,则Y(OH)n也是强碱;⑤除第一周期外,第n周期的最后一种金属元素位于第n主族( )
A.①②④
B.①③⑤
C.②③④
D.②④⑤
参考答案:①同一主族元素,非金属单质的熔点与晶体结构有关,金属晶体族原子半径越大,金属单质的熔点越小,晶体结构相同的卤族原子半径越大,非金属单质的熔点越高,故①错误;
②同一周期元素的原子(除稀有气体)自左而右原子半径减小,金属性减弱,故半径越大越容易失去电子,故②正确;
③若R2-和M+的电子层结构相同,核电荷数R>M,核电荷数越大,离子半径越小,故微粒半径:M+<R2-,故③错误;
④原子半径X小于Y的同一主族的两种元素,原子序数Y>X,若X(OH)n是强碱,则金属性Y>X,则Y(OH)n也是强碱,故④正确;
⑤除第一周期外,当最外层电子数>周期数为非金属元素,每周期的最后一种金属元素为主族元素,且最外层电子数=周期数,故第n周期的最后一种金属元素位于第n主族,故⑤正确;
故选D.
本题解析:
本题难度:一般
3、选择题 W、X、Y、Z是短周期元素,其部分性质如下表,下列说法正确的是( )
| W | 单质是淡黄色固体
X
在地壳中的含量居第二位
Y
原子最外层电子数是电子总数的
Z
第三周期原子半径最小的金属
|
A.Z的氧化物属于碱性氧化物
B.最高价氧化物对应水化物的酸性:Y>X
C.离子半径:Z>W
D.气态氢化物的热稳定性:X>W
参考答案:W、X、Y、Z是短周期元素,W单质是淡黄色固体,则W为S;X在地壳中的含量居第二位,则X为Si;Y原子最外层电子数是电子总数的23,若Y处于第二周期,令最外层电子数为a,则(2+a)×23=a,解得a=4,为碳元素,若Y处于第三周期,令最外层电子数为a,则(2+8+a)×23=a,解得a=20,不符合题意,故Y为碳元素;Z是第三周期原子半径最小的金属,则Z为Al,
A.氧化铝是两性氧化物,故A错误;
B.X为Si、Y为C,非金属性C>Si,故最高价氧化物对应水化物的酸性:Y>X,故B正确;
C.S2-离子比Al3+多一个电子层,故离子半径S2->Al3+,故C错误;
D.非金属性S>Si,故氢化物稳定性H2S>SiH4,故D错误,
故选B.
本题解析:
本题难度:一般
4、选择题 下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
[? ]
A.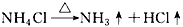
B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列说法中,正确的是( )
A.不可能有非金属单质置换出金属单质的置换反应
B.仅由非金属元素组成的化合物一定是共价化合物
C.能用同一通式表示的几种物质一定互为同系物
D.电能与化学能的相互转化过程中一定有新物质产生
参考答案:D
本题解析:
本题难度:一般