|
高中化学知识点讲解《物质的量》试题巩固(2017年最新版)(十)
2018-03-17 06:00:18
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.78 g 苯含有碳碳双键的数目为3NA
B.常温常压下,22.4 L二氧化碳含有的原子总数为3NA
C.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA
D.1 mol Fe与足量稀HNO3反应,转移3 NA个电子
|
参考答案:D
本题解析:A、苯分子中不存在碳碳双键,错误;B、常温常压下、22.4LCO2的物质的量不是1mol,错误;D、次氯酸钠是强碱弱酸盐,溶于水水解,则1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目小于NA,错误;D、硝酸过量,将铁氧化为铁离子,所以1 mol Fe与足量稀HNO3反应,转移3 NA个电子,正确,答案选D。
考点:考查阿伏伽德罗常数的计算
本题难度:一般
2、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是
A.0.2mol铁粉与足量水蒸气反应生成的H2分子数为0.3NA
B.常温常压下,0.1mol Na2O2与CO2完全反应转移电子数为0.1NA
C.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
参考答案:B
本题解析:A、高温下铁与水蒸气反应的方程式为3Fe+4H2O(g)  Fe3O4+4H2,因此0.2mol铁粉与足量水蒸气反应生成的H2分子数为 Fe3O4+4H2,因此0.2mol铁粉与足量水蒸气反应生成的H2分子数为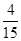 NA,A不正确;B、过氧化钠与CO2反应的方程式为2Na2O2+2CO2=2Na2CO3+O2,在反应中过氧化钠既是氧化剂,也是还原剂。其中氧元素的化合价从-1价部分升高到0价,部分降低到-2价,因此1mol过氧化钠在反应中转移1mol,则常温常压下,0.1mol Na2O2与CO2完全反应转移电子数为0.1NA,B正确;C、铜与浓硫酸反应的方程式为Cu+2H2SO4(浓) NA,A不正确;B、过氧化钠与CO2反应的方程式为2Na2O2+2CO2=2Na2CO3+O2,在反应中过氧化钠既是氧化剂,也是还原剂。其中氧元素的化合价从-1价部分升高到0价,部分降低到-2价,因此1mol过氧化钠在反应中转移1mol,则常温常压下,0.1mol Na2O2与CO2完全反应转移电子数为0.1NA,B正确;C、铜与浓硫酸反应的方程式为Cu+2H2SO4(浓)  CuSO4+2H2O+SO2↑,随着反应的进行硫酸的浓度逐渐降低,而稀硫酸与铜不反应。50mL18.4mol·L-1浓硫酸的物质的量=0.05L×18.4mol/L=0.92mol,与足量铜微热反应,生成SO2分子的数目小于0.46NA,C不正确;D、合成氨的反应是可逆反应,反应物的转化率达不到100%,因此某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目小于0.6NA,D不正确,答案选B。 CuSO4+2H2O+SO2↑,随着反应的进行硫酸的浓度逐渐降低,而稀硫酸与铜不反应。50mL18.4mol·L-1浓硫酸的物质的量=0.05L×18.4mol/L=0.92mol,与足量铜微热反应,生成SO2分子的数目小于0.46NA,C不正确;D、合成氨的反应是可逆反应,反应物的转化率达不到100%,因此某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目小于0.6NA,D不正确,答案选B。
本题难度:一般
3、选择题 NaOH在水中电离出Na+和OH-,要使溶液中每100个水分子中含有1个Na+,则在90g水中需溶解NaOH的质量是(?)
A.0.9g
B.1g
C.2g
D.9g
参考答案:C
本题解析:略
本题难度:简单
4、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是(?)
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,64gSO2气体中含有的原子数为3NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.标准状况下,11.2LH2O含有的分子数为0.5NA
参考答案:B
本题解析:单质氦是单原子分子,所以A中在标准状况下的体积是22.4L;B中64gSO2是1mol,含有3mol氧原子,B正确;常温常压下,11.2L氯气不是0.5mol,C不正确;标准状况下,水不是气体,不能适用于气体摩尔体积,D不正确,因此正确的答案选B。
本题难度:一般
5、填空题 Ba2+是一种重金属离子,环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL?0.100mol/L标准Na2S2O3溶液,所需要的玻璃仪器除量筒、玻璃棒、烧杯外,还需要_____________。
(2)需准确称取Na2S2O3固体的质量为________g
(3)另取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。有关的离子方程式为:
①Cr2O72-+6I-+14H+==2Cr3++3I2+7H2O
②I2+2S2O32-==2I-+S4O62-
试计算该工厂废水中Ba2+的物质的量浓度。
参考答案:(1)250mL容量瓶、胶头滴管
(2)3.95g
(3)c(Ba2+)=0.024?mol/L
本题解析:
本题难度:一般
|