1、选择题 下列物质的主要成分不正确的是
[? ]
A.赤铁矿:Fe2O3?
B.铜绿:CuO
C.磁铁矿:Fe3O4?
D.铝土矿:Al2O3
2、填空题 铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应: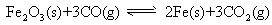
①该反应的平衡常数表达式为:K=_______________;
②该温度下,在2L盛有粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为________________。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
①____________________________;②____________________________。
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v) 和温度(T)的关系示意图中与铝热反应最接近的是______________。
a.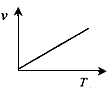
b.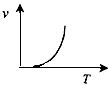
c.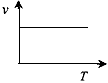
d.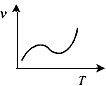
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:_____________________________;欲使上述体系中浓度增加,可加入的物质是__________________________。
3、选择题 相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是
[? ]
A.Al? ?
B.Al(OH)3
C.AlCl3? ?
D.Al2O3
4、简答题 某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡.触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性.若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化.
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是______.
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择:______.
(2)铝片表面出现的暗红色物质的过程中发生的离子反应方程式是______.?用离子方程式解释产生气泡的原因:______.
(3)放出的气体是______,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是______.(写出一点即可)
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是______.
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应
A
正极
NaOH
Al-3e-=Al3+
2H2O+2e-=2OH-+H2↑
B
负极
稀盐酸
2Al-6e-=2Al3+
6H++6e-=3H2↑
C
正极
浓硝酸
Cu-2e--=Cu2+
2NO3-+4H+-4e-=2NO2↑+2H2O
D
负极
稀硝酸
Cu-2e-=Cu2+
2NO3-+8H+=2NO↑+4H2O+6e-
|
其中正确的是______,由此推知,金属作电极不仅与本身性质相关,而且与______有关.
5、选择题 以氧化铝为原料制取氢氧化铝,最好的方法是
[? ]
A.将氧化铝溶于水
B.将氧化铝先溶于盐酸中,之后滴加氨水
C.将氧化铝溶于盐酸中,之后滴加氢氧化钠溶液
D.将氧化铝溶于氢氧化钾