|
高考化学知识点总结《有关氧化还原反应的计算》高频考点特训(2017年练习版)(十)
2018-03-17 06:01:28
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮用水处理的新技术。已知反应
Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2发生反应,有12 mol e-发生转移
D.Na2FeO4能消毒杀菌是因其具有强氧化性
|
参考答案:D
本题解析:A、分析题给反应知,Na2O2中氧元素化合价由-1价降为-2价,被还原,Na2O2为氧化剂,错误;B、Fe2O3中铁元素化合价由+3价升高为+6价,在反应中失去电子,错误;C、反应中Na2O2中氧元素化合价由-1价降为-2价,3molNa2O2发生反应,有6mol电子转移,错误;D、Na2FeO4中Fe为+6价,具有强氧化性,可用于杀菌消毒,正确。
考点:考查氧化还原反应。
本题难度:一般
2、选择题 下列化学变化中,必须加入还原剂才能实现的是
A.C→CO2
B.Cl2→Cl-
C.CuO→Cu
D.SO2→SO3
参考答案:C
本题解析:C→CO2发生的是氧化反应,所以要加入氧化剂;Cl2→Cl-,Cl化合价降低,发生的是还原反应,可以加还原剂或不加还原剂,因Cl2可发生自身氧化还原反应(如Cl2+2NaOH=NaCl+NaClO+H2O); CuO→Cu发生的是还原反应,需要加入还原剂;SO2→SO3发生的是氧化反应,需要加入氧化剂。
点评:注意一些自身氧化还原反应。
本题难度:简单
3、填空题 研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3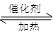 7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。 7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g)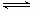 2SO3(g) ΔH="-196.6" kJ·mol-1 2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g)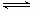 2NO2(g) ΔH="-113.0" kJ·mol-1 2NO2(g) ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g)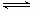 SO3(g)+NO(g)的ΔH= kJ·mol-1。 SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。[91exam.org
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
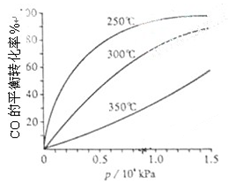
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)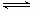 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
参考答案:(1)3NO2+H2O=NO+2HNO3 6.72
(2)-41.8 b 8/3
(3)< 在1.3×104kPa下,CO的转化率已经很高,如果增大压强CO的转化率提高不大,而生产成本增加(3分)
本题解析:(1)二氧化氮与水反应的方程式为3NO2+H2O=NO+2HNO3;在6NO2+ 8NH3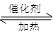 7N2+12 H2O反应中,每消耗6mol二氧化氮,转移电子24mol电子,当转移1.2 mol电子时,消耗二氧化氮0.3mol标准状况下的体积是6.72L 7N2+12 H2O反应中,每消耗6mol二氧化氮,转移电子24mol电子,当转移1.2 mol电子时,消耗二氧化氮0.3mol标准状况下的体积是6.72L
(2)根据盖斯定律得:2SO2(g)+O2(g)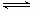 2SO3(g) ΔH="-196.6" kJ·mol-1 (1) 2SO3(g) ΔH="-196.6" kJ·mol-1 (1)
2NO(g)+O2(g)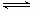 2NO2(g) ΔH="-113.0" kJ·mol-1 (2) 2NO2(g) ΔH="-113.0" kJ·mol-1 (2)
NO2(g)+SO2(g)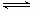 SO3(g)+NO(g)的ΔH可由[(1)-(2)] ÷2得到ΔH="-41.8" kJ·mol-1; SO3(g)+NO(g)的ΔH可由[(1)-(2)] ÷2得到ΔH="-41.8" kJ·mol-1;
该反应的特点是反应前后气体体积无变化的可逆反应,a、气体的压强始终不变,不能作为平衡到达的标志,错误;b、随着反应的进行气体的颜色逐渐变浅,达平衡时,气体颜色不再变化,正确;c、SO3和NO的体积比在反应的过程中始终不变,不能作为平衡到达的标志,错误;d、对逆反应而言,每消耗1 mol SO3的同时生成1 molNO2,不能作为平衡到达的标志,错误;答案选b。
设达平衡时SO3、NO的浓度为x,则消耗NO2、SO2的浓度也为x,剩余NO2、SO2的浓度为1-x、2-x,所以(1-x)/(2-x)=1:6,解得x=0.8,所以平衡常数K=0.82/0.2×1.2=8/3
(3)由图知,随温度升高CO的平衡转化率降低,说明升高温度平衡逆向移动。正反应为放热反应,ΔH<0,
实际生产时,选择1.3×104kPa的理由是在1.3×104kPa下,CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加
考点:考查化学方程式的书写,盖斯定律的应用,平衡状态的判断,平衡常数的计算及解决分析图像的能力
本题难度:困难
4、简答题 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O.现将23.2g软锰矿石(含MnO2的质量分数为75%)与足量浓盐酸完全反应(杂质不参加反应).计算:
(1)生成的Cl2的体积(标准状况).(2)参加反应的HCl的物质的量.
参考答案:23.2g软锰矿石中含MnO2的质量为:23.2g×75%=17.4g,则n(MnO2)=17.4g87g/mol=0.2mol,
(1)设生成的Cl2的体积为V,
MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O
1mol?22.4L
0.2mol? V
V=22.4L×0.2mol1mol=4.48L,
答:生成的Cl2的体积在标准状况下为4.48L;
(2)设参加反应的HCl的物质的量为n,
MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O
1mol? 4mol
0.2mol n
n=4mol×0.2mol1mol=0.8mol,
答:参加反应的HCl的物质的量为0.8mol.
本题解析:
本题难度:一般
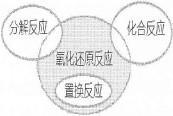
5、选择题 下列属于右边关系图中阴影部分的化学反应是
A.2Na+O2 Na2O2 Na2O2
B.2Na2O2+2CO2=2Na2CO3+O2
C.2KMnO4 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑
D.Fe+H2SO4=FeSO4+H2↑
参考答案:B
本题解析:A、钠燃烧属于化合反应,错误;B、氧元素化合价既升高又降低,属于氧化还原反应,但不是置换反应,正确;C、高锰酸钾发生分解反应,错误;D、铁与稀硫酸发生置换反应,错误。
本题难度:一般
|