| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《反应速率与平衡的有关计算》试题预测(2017年最新版)(八)
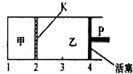 参考答案:2molC和2molD相当于2molA和4molB,即乙容器内的气体的物质的量为甲容器内的气体的物质的量的2倍,而乙容器的体积为甲容器的体积的2倍,在相同温度下达到相同平衡状态,甲、乙容器内对应物质的浓度相同,各组分的含量相同. 本题解析: 本题难度:一般 4、选择题 下列事实不能用勒沙特列原理解释的是: 参考答案:B 本题解析:B项中,因为亚铁离子容易被氧化成铁离子,造成FeSO4溶液不纯,因此常在该溶液中加入铁粉,将铁离子还原成亚铁离子:Fe3++Fe=2Fe2+,利用的不是勒沙特列原理。 本题难度:一般 5、选择题 已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3 B.相同条件下的酸性:H2CO3<HCN C.三种溶液中均存在电离平衡和水解平衡 D.升高Na2CO3溶液的温度, 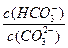 减小 减小参考答案:C 本题解析:阳离子均为Na+和H+,Na2CO3溶液中Na+浓度是其他两种的两倍,阳离子浓度最大,NaCN溶液和NaHCO3溶泼中Na+浓度相等, NaCN溶液中H+浓度小于NaHCO3溶液,故阳离子浓度大小顺序为Na2CO3 > NaHCO3 >NaCN,A项错误;HCO 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《乙醇的性质.. | |