1、填空题 (每空1分,共7分)下表为元素周期表的一部分,请回答有关问题:
?
| IA
| IIA
| IIIA
| IVA
| VA
| VIA
| VIIA
| 0
|
2
| ?
| ?
| ?
| ?
| ①
| ?
| ②
| ?
|
3
| ?
| ③
| ④
| ⑤
| ?
| ⑥
| ⑦
| ⑧
|
4
| ⑨
| ?
| ?
| ?
| ?
| ?
| ⑩
| ?
|
(1)⑤和⑧的元素符号是_________和__________;
(2)表中最活泼的金属是_________,非金属性最强的元素是_________;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是______,分别写出该元素的氢氧化物与⑥、⑨
的最高价氧化物对应水化物反应的化学方程式__________________________________;
__________________________________.
参考答案:(1)、Si? Ar?(2)K? F?
(3)Al? 2Al(OH)3+3H2SO4=2Al2(SO4)3+3H2O? Al(OH)3+KOH=KAlO2+2H2O
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可判断①~⑩分别为N、F、Mg、Al、Si、S、Cl、Ar、K、Br。同周期元素自左向右金属性逐渐减弱,非金属性逐渐增强。同主族自上而下金属性逐渐增强,非金属性逐渐减弱。所以金属性最强的是K,非金属性最强的是F。氢氧化铝是两性氢氧化物既能溶于强碱,也能溶于酸中。
本题难度:一般
2、选择题 短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示。下列说法正确的是
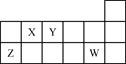
A.原子半径的大小顺序:rZ>rY>rX
B.氢化物的稳定性强弱顺序:XH4>YH3>HW
C.Y的氢化物与W的氢化物化合所得产物中只含有共价键
D.X、Y、Z、W四种元素的最高价氧化物对应水化物均能与强碱反应
参考答案:D
本题解析:根据短周期元素X、Y、Z、W在元素周期表中的相对位置和元素周期表的结构推断,X为碳元素,Y为氮元素,Z为铝元素,W为氯元素。A、根据同周期同主族元素原子半径递变规律知,原子半径的大小顺序应为:rZ>rX>rY(rAl>rC>rN),错误;B、根据同周期元素气态氢化物的稳定性由左到右依次减弱知,氢化物的稳定性强弱顺序:XH4<YH3(CH4<NH3),错误;C、Y的氢化物NH3与W的氢化物HCl化合所得产物NH4Cl中既含有离子键又含有共价键,错误;D、X、Y、Z、W四种元素的最高价氧化物对应水化物分别为H2CO3、HNO3、Al(OH)3、HClO4,H2CO3、HNO3、HClO4属于酸,Al(OH)3为两性氢氧化物均能与强碱反应,正确。
本题难度:一般
3、选择题 根据物质结构和元素周期表进行分析判断,下列叙述不正确的是(?)
A.第15列元素的最高价氧化物为R2O5
B.第三周期元素的离子半径,从左到右逐渐减小
C.同周期第ⅡA族与第IIIA族的元素原子序数之差可能为1或11或25
D.只含有非金属元素的化合物不一定是共价化合物
参考答案:B
本题解析:第15列元素是第ⅤA族元素,最高价是+5价,所以最高价氧化物为R2O5,A正确;第三周期元素的金属阳离子离子半径小于非金属元素的阴离子半径,即选项B不正确;由于从第四周期开始第ⅡA族与第IIIA族中间相隔副族和第Ⅷ族,因此选项C正确;D正确,例如氯化铝是共价化合物,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。主要是考查学生对周期表和元素周期律的熟悉了解程度,特别是灵活运用元素周期律解决实际问题的能力,有利于培养学生的逻辑推理能力,提高学生的应试能力和灵活应变能力。
本题难度:简单
4、选择题 下列各组元素均属于p区元素的是
A.H、He、N
B.O、S、P
C.Fe、Ar、Cl
D.Na、Li、Mg
参考答案:B
本题解析:略
本题难度:一般
5、填空题 A、B、C、D、E五种短周期元素,原子序数依次增大,A原子的最外层电子排布式为nsnnpn+1,C、D原子核外都有一个未成对电子,又知B和E为同一主族,C、D、E为同周期,且B、E的原子序数之和等于C、D的原子序数之和
(1) E离子的基态电子排布式? _______________
(2)元素B、C、D、E的原子半径从大到小的顺序是________(用元素符号填写,下同)
(3)元素A、B、C、D的第一电离能从大到小的顺序是?
(4)写出C单质与B单质加热时生成的化合物的电子式?
(5) D元素在周期表中的位置是_______________,中学化学实验室中制取D的最高价氧化物对应的水化物的离子方程式为___________________________________
(6)已知:①A2(g)+B?2(g)=2AB(g)?ΔH1=akJ/mol
②2AB(g)+B2(g)=2AB2(g)?ΔH2=bkJ/mol
③AB(g)+AB2(g)= A2B3(g)?ΔH3=ckJ/mol
则2A2(g)+3B2(g)=2A2B3(g)?ΔH=?kJ/mol (用a.b.c表示)
参考答案:(每空2分,共14分)
(1) 1s22s22p63s23p6
(2) Na>Al>S>O
(3)N>O>Al>Na
(4)Na+[: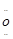 :
: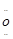 :]2-Na+
:]2-Na+
(5) 第三周期,ⅢA族,? Al3+ +3NH3·H2O=Al(OH)3↓+3NH4+
(6)? ΔH=(2a+b+2c)kJ/mol
本题解析:由A的电子层结构,可以推知为2s22p3,为N,又B和E为同一主族,C、D、E为同周期,B为O或F,C、D、E为第三周期,外层有一个未成对电子的可能为Na和Al,从而确定B为O、E为S。
(1)要注意为S的离子
(2)原子半径先比较电子层,电子层越多半径越大,再比较核电荷数,越多半径越小
(3)第一电离能整体上同周期从左到右为增大趋势,同主族从上到下,减小;这里N为半充满,反常。
(4)Na2O2的电子式
(5)Al的位置以及制备Al(OH)3,要考虑氢氧化铝的两性,既能溶于酸又能溶于碱,故不能用强碱,用氨水。
(6)由盖斯定律有目标反应等于①×2+②+③×2
本题难度:一般