1、选择题 某溶液X仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为0.1mol某同学向溶液X中加入足量的盐酸,有气体生成,且反应溶液中阴离子的种类没有变化.下列说法正确的是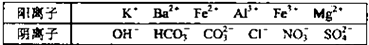
A.溶液X中可能含有HCO-3或CO2-3
B.溶液X中一定不存在Al3+、Ba2+,可能存在K+
C.向反应后的溶液中滴加KSCN溶液,无明显现象
D.向溶液X中加入足量的NaOH溶液,充分反应后过滤将沉淀,洗涤,干燥、灼烧至恒重,能得到固体质量为12g
参考答案:D
本题解析:分析:各种离子的物质的量均为0.1mol某同学向溶液X中加入足量的盐酸,有气体生成,且反应溶液中阴离子的种类没有变化.产生气体可能是碳酸根离子或碳酸氢根离子,若向原溶液中加入足量的盐酸,有无色气体生成,反应后溶液中阴离子种类没有变化,根据表中的离子,可以推知是 Fe2+、NO3-在酸性环境下生成的一氧化氮,加入盐酸,溶液中阴离子种类不变,所以原来溶液中含有Cl-,若只含有氯离子和硝酸根离子,二者的量均为0.1mol,根据电何守恒是不可能的,所以还含有硫酸根离子,再根据电荷守恒确定还含有一种带有两个正电荷的镁离子,所以含有的五种离子为:Cl-、NO3-、SO42-;Fe2+、Mg2+;
A、HCO3-与CO32-均可与盐酸反应生成二氧化碳;
B、根据离子共存知识和离子在溶液中的电荷守恒分析来回答;
C、若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,说明原溶液中含有Cl-,该气体只能是NO,说明含有具有氧化性的NO3-和还原性的Fe2+,反应后溶液中含有三价铁离子;
D、根据元素守恒,0.1mol的Mg2+产生0.1mol的MgO,质量为4g,0.1mol的Fe2+产生0.05mol的Fe2O3,质量为8g,加起来一共就是12g.
解答:A、往溶液中加入的是过量的盐酸,如果有碳酸根离子或碳酸氢跟离子的话会完全反应生成二氧化碳,所以就不可能保证阴离子种类没变化,HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化;故A错误;
B、依据分析推断可知,结合溶液中电荷守恒,溶液X中一定不存在Al3+、Ba2+、K+,故B错误;
C、反应后溶液中含有三价铁离子,向反应后的溶液中滴加KSCN溶液,溶液呈血红色;故C错误;
D、若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧到恒重,得到固体是三氧化二铁以及氧化镁,根据原子守恒,则生成0.05molFe2O3和0.1mol的MgO,质量为:0.05mol×160g/mol+0.1mol×40g/mol=12g,故D正确;
故选D.
点评:本题考查了离子性质的应用和实验方案的推断和分析判断,离子共存和离子变化特征,元素守恒和溶液中电荷守恒的计算应用是判断的关键,题目难度较大.
本题难度:困难
2、选择题 要使Ba2+,Al3+,Cu2+,Mg2+,Ag+五种离子从混合溶液中逐一沉淀析出,选用的试剂和加入的顺序正确的是?
A.Na2SO4→HCl→H2S→NaOH→CO2
B.HCl→H2SO4→H2S→NaOH→CO2
C.Na2S→Na2SO4→NaCl→NaOH→CO2
D.NaCl→Na2SO4→NaOH→H2S→CO2
参考答案:B
本题解析:首先分析A,SO42-加入后Ag+和Ba2+都沉淀,故A不对。分析C,加入S2-,Ag2+和Cu2+同时沉淀。分析D,加入NaCl,Ag+沉淀,加入Na2SO4,Ba2+沉淀,加入NaOH后Mg2+沉淀,Al3+转化为AlO2-,加入H2S后Ca2+和AlO2-同时沉淀,故只有B对。
本题难度:一般
3、选择题 下列离子方程式正确的是
A.碳酸氢钠水解:HCO3-+H2O?H3O++CO32-
B.醋酸铵溶于水:CH3COONH4+H2O?CH3COOH+NH3?H2O
C.硫酸钙悬浊液中加入碳酸钠:CaSO4(s)+CO32-?(aq)?CaCO3(s)+SO42-?(aq)
D.硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O
参考答案:C
本题解析:分析:A、选项在是碳酸氢根离子的电离;
B、醋酸铵是强电解质完全电离;
C、沉淀转化是想更难溶的方向进行;
D、硫酸氢钠和氢氧化钡反应呈中性,按照2:1反应.
解答:A、碳酸氢钠水解:HCO3-+H2O?OH-+H2CO3 ,故A错误;
B、醋酸铵溶于水水解CH3COO-+NH4++H2O?CH3COOH+NH3?H2O,故B错误;
C、硫酸钙悬浊液中加入碳酸钠沉淀转化为碳酸钙:CaSO4(s)+CO32-?(aq)?CaCO3(s)+SO42-?(aq),故C正确;
D、硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故D错误;
故选C.
点评:本题考查了离子方程式的书写方法和注意问题,注意判断电离和水解的区分,电解质的判断,沉淀转化的应用,酸式盐和碱反应的定量关系判断,题目较简单.
本题难度:一般
4、选择题 稀硫酸和氢氧化钡溶液混合,反应符合离子反应发生条件:①生成难溶的物质,②生成难电离的物质,③生成挥发性物质中的
[? ]
A.①②
B.①③
C.②③
D.①②③
参考答案:A
本题解析:
本题难度:简单
5、选择题 将15mL2mol/LNa2CO3溶液逐滴加入到20mL1.5mol/LMCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是
A.4
B.3
C.2
D.1
参考答案:C
本题解析:分析:Na2CO3溶液逐滴加入到MCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,同时生成氯化钠,钠离子的物质的量与氯离子的物质的量相等,据此计算n值.
解答:将15mL2mol/LNa2CO3溶液逐滴加入到20mL1.5mol/LMCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,同时生成氯化钠,钠离子的物质的量与氯离子的物质的量相等,则:
15mL×2mol/L×2=20mL×1.5mol/L×n,解得n=2.
故选:C.
点评:考查离子方程式的有关计算,难度不大,注意离子反应发生的条件与离子方程式书写,可以根据碳酸根与Mn+离子所带电荷数相等计算.
本题难度:简单