1、选择题 下图为周期表中短周期的一部分,若a原子最外层上有5个电子,则下列说法中不正确的是
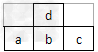
[? ]
A.d单质可跟b的氢化物的水溶液反应
B.原子半径a?>?b?>?d
C.c的氢化物比a的氢化物稳定,且其还原性更弱
D.a的最高价氧化物的水化物比b的最高价氧化物的水化物酸性强
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列四种元素中非金属性最强的是( )
A.原子最外层电子数为次外层电子数的2倍
B.第三周期ⅢA族元素
C.原子核外L层电子数为K层电子数的三倍
D.第16号元素
参考答案:A.原子最外层电子数为次外层电子数的2倍为Be;
B.第三周期ⅢA族元素为Al;
C.原子核外L层电子数为K层电子数的三倍为O元素;
D.第16号元素为S,
其中Be和Al只具有较强的金属性,O和S具有非金属性,且二者位于同于主族,根据同主族元素从上到下元素的非金属性逐渐降低可知非金属性O>S,
故选C.
本题解析:
本题难度:简单
3、选择题 R、M、T、G、J为原子序数依次递增的同一周期主族元素,下列说法一定正确的是(m、n均为正整数)( )
A.若HnJOm为强酸,则G一定是位于ⅤA族以后的活泼非金属元素
B.若M(OH)n+1为强碱,则R(OH)n也为强碱
C.若T的最低化合价为-3,则J的最高正化合价为+7
D.若M的最高正化合价为+4,则五种元素都是非金属元素
参考答案:A.若HnJOm为强酸,如J为Cl元素,则G可能为Si或P,为不活泼非金属元素,故A错误;
B.同周期元素从左到右元素的金属性逐渐减弱,若M(OH)n+1为强碱,则R(OH)n一定为强碱,故B正确;
C.若T的最低化合价为-3,如T为N元素,则J为F元素,无正价,故C错误;
D.以上元素不一定为短周期元素,如M为Sn元素,则T为Sb元素,为金属元素,故D错误.
故选B.
本题解析:
本题难度:一般
4、选择题 下列元素中,最高正化合价数值最大的是?
[? ]
A、C
B、S
C、F
D、Ne
参考答案:B
本题解析:
本题难度:简单
5、选择题 运用元素周期律分析下面推断,其中错误的是( ? ?)
A.已知Ra是第七周期、ⅡA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强
B.已知As是第四周期、VA族的元素,故AsH3的稳定性比 NH3的稳定性强
C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应比Na与水反应更剧烈
D.已知Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小
参考答案:B
本题解析:
本题难度:简单