1、填空题 生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式__________。
(2)根据等电子原理,写出CO分子的结构式________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是________ ;甲醛分子中碳原子轨道的杂化类型为________。
②甲醛分子的空间构型是________;1 mol甲醛分子中σ键的数目为_______。
③在1个Cu2O晶胞中(结构如下图所示),所包含的Cu原子数目为______。
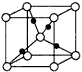
2、填空题 三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐。
(1)该反应的化学方程式为______________,生成物NF3中氮原子的杂化方式为_____________ ,NF3分子空间构型为____________ ;
(2)N、F两种元素的氢化物稳定性比较,NH3 _________HF(选填“>”或“<”);
(3)N3-被称为类卤离子,写出1种与N3-互为等电子体的分子的化学式___________ ;
(4)元素A基态原子的核外电子排布式为1s22s22p63s23p64s2,A跟氟可形成离子化合物,其晶胞结构如下图,该离子化合物的化学式为______________ 。
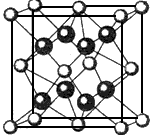
3、选择题 下列叙述正确的是( )?
A.离子晶体中一定含有活泼金属元素的离子?
B.原子晶体都是化合物?
C.固态不导电、水溶液能导电,这一性质能说明某晶体一定是离子晶体?
D.离子晶体一般具有较高的熔点?
4、填空题 X、Y、Z、Q、W为按原予序数由小到大排列的五种短周期元素。已知:①X与Q处于同一主族,其原子价电子排布式都为n s2np2,且X原子半径小于Q;②Y元素是地壳中含量最多的元素;W元素的电负性路小于Y元素,在W原子的价电子排布式中,p轨道上只有1个未成对电子;③Z元素的电离能数据见下表(kJ·mol-1)
s2np2,且X原子半径小于Q;②Y元素是地壳中含量最多的元素;W元素的电负性路小于Y元素,在W原子的价电子排布式中,p轨道上只有1个未成对电子;③Z元素的电离能数据见下表(kJ·mol-1)
I1
| I2
| I3
| I4
| …
|
496
| 4562
| 6912
| 9540
| …
|
请回答:
(1)XY2分子的空间构型为?。
(2)QX的晶体结构与金刚石的相似,微粒间存在的作用力是?。
(3)晶体ZW的熔点比晶体XW4明显高的原因是?。
(4)XY2在高温高压下所形成的晶胞如图所示。该晶体的类型属于?(选填“分子”、“原子”、“离子”或“金属”)漏体,该晶体中X原子的杂化形式为___?。
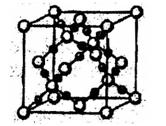
(5)氧化物MO的电子总数与QX的相等,则M为?。(填元素符号);MO是优良的耐高温材料,其晶体结构与ZW晶体结构相似,MO的熔点比CaO的高,其原因是?。
5、选择题 在高压下,用激光器加热到1800 K时,人们成功制得了原子晶体——干冰,下列推断正确的是(?)
A.该干冰晶体有很高的熔点和沸点
B.该干冰晶体可用作制冷材料
C.该干冰晶体和石英一样可用作耐磨材料
D.该干冰晶体中的键角是180°