1、选择题 下列叙述不正确的是
A.质量相等的O2和O3中所含原子数相等
B.物质的量相等的O2和O3中含分子数相等
C.质量相等的CO和CO2中所含碳原子数相等
D.物质的量相等的CO和CO2中含碳原子数相等
参考答案:C
本题解析:
本题难度:困难
2、选择题 下列图示的四种实验操作名称从左到右依次是
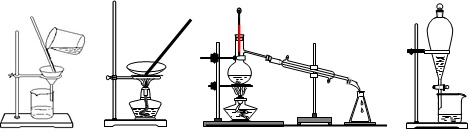
A.过滤、蒸发、蒸馏、分液
B.过滤、蒸馏、蒸发、分液
C.蒸发、蒸馏、过滤、分液
D.分液、蒸馏、蒸发、过滤
参考答案:A
本题解析:从左到右依次为过滤、蒸发、蒸馏、分液,选A。
本题难度:一般
3、实验题 实验桌上有六瓶试剂,只知其可能为醋酸、盐酸、硫酸、氢氧化钾、氢氧化钙以及氨水。该同学取出其中两瓶,进行简易分析实验以辨识二者成分。
实验记录以下:
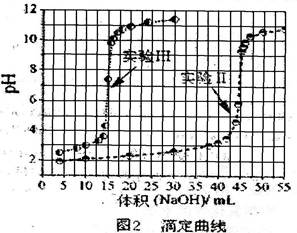 实验I?从第一瓶溶液中取出25.00 mL,以标准NaOH溶液滴定,滴定结果列于表1中。
实验I?从第一瓶溶液中取出25.00 mL,以标准NaOH溶液滴定,滴定结果列于表1中。
体积(NaOH)/mL
| pH
|
5.0
| 2.2
|
10.0
| 2.4
|
| 20.0 | 3.0
|
24.0
| 3.8
|
24.8
| 4.5
|
25.0
| 7.0
|
25.2
| 9.5
|
26.0
| 10.0
|
30.0
| 10.7
|
?
实验Ⅱ?从第一瓶溶液中取25.00 mL后,加入10.00 mL、0.01000 mol/L 的硫酸,再以同一标准NaOH溶液滴定,滴定结果绘于图2中。
实验Ⅲ?从第一瓶与第二瓶溶液中分别取出25.00 mL与10.00 mL,相互混合之后,再以标NaOH溶液滴定。滴定结果也绘于图2中。
实验IV?完成实验III后,再加入数滴BaCl2,溶液并无沉淀出现,但若改加草酸钠,则溶液出现白色沉淀。
(1)进行实验I时,若用酚酞作指示剂,判断达滴定终点对的依据是:_____________________。
(2)计算标准NaOH溶液的浓度______________mol/L。
(3)第二瓶溶液成分及其物质的量浓度_______________________、_______________mol/L。
参考答案:

本题解析:(1)滴定终点是恰好变色且30S再改变颜色。
(2)由图表中的数据直接展开计算即可。
本题难度:一般
4、选择题 下列物质的分离方法不正确的是
[? ]
A.用过滤的方法除去食盐中泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用水冲洗的方法从沙里淘金
参考答案:C
本题解析:
本题难度:简单
5、填空题 实验室模拟合成氨和氨催化氧化的流程如下:


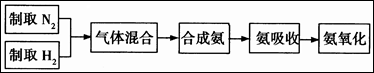
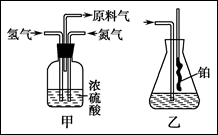
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
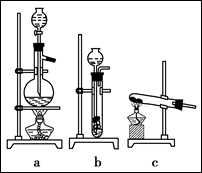
(1)从上图中选择制取气体的合适装置:
氮气?、氢气?。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有?、?。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,?(填“会”或“不会”)发生倒吸,原因是:?。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:?,锥形瓶中还可观察到的现象是:?。
(5)写出乙装置中氨氧化的化学方程式:?。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、?、?离子。
(B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:

(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
?上(用以下所给仪器的编号填入,下同),取用坩埚应使用?,灼烧后的坩埚应放在?上,不能直接放在桌面上。
实验所用仪器:A.蒸发皿? B.石棉网? C.泥三角? D.表面皿? E.坩埚钳? F.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是?。
A.灼烧过程中部分氧化铜被还原? B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜? D.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、?、冷却结晶、?、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:?、?。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行
?次。
(6)若测定结果x值偏高,可能的原因是?。
a.加热温度过高? b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却? d.胆矾晶体部分风化
参考答案:(A)(1)a、b?(2)干燥气体?控制氢气和氮气的流速


(3)不会?因为混合气体中含有大量难溶于水的氮、氢两种气体
(4)说明氨的氧化反应是一个放热反应?有红棕色气体产生
(5)4NH3+5O2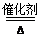 4NO+6H2O
4NO+6H2O
(6)NH ? NO
? NO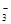
(B)(1)C? E? B
(2)A? B?(3)蒸发?过滤?
(4)产生等量胆矾途径Ⅱ消耗硫酸少?途径Ⅱ不会产生污染大气的气体
(5)4?(6)a
本题解析:(A)(1)由题给反应物的状态,NaNO2和NH4Cl都是饱和溶液,可推知N2用a装置,而H2是由锌粒(固)和稀酸(液)来制取,则可用b制取。
(2)干燥气体和调节(或控制)H2和N2的流速。
(3)不会,因合成氨的反应是一个可逆反应,生成的混合气体除NH3以外还有大量的N2和H2存在。
(4)从能使铂丝保持红热可以推知,氨的氧化反应是一个放热反应。根据氨氧化的产物看有NO生成,NO被O2氧化又产生NO2,所以锥形瓶中会看到有红棕色气体产生。
(5)乙装置中氨氧化的反应方程式为4NH3+5O2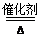 4NO+6H2O。
4NO+6H2O。
(6)因氨氧化生成的NO与O2、H2O反应生成HNO3,未氧化的氨与HNO3反应生成NH4NO3。因此,反应结束后,锥形瓶内的溶液中除有H+、OH-外,还应有NH 和NO
和NO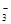 。
。
(B)(1)因坩埚加热后温度较高,应放在泥三角上进行加热,且取用坩埚时要用坩埚钳,并且为防止坩埚炸裂和烧坏桌面,烧后的坩埚要在石棉网上冷却,不能直接放在桌面上。
(2)灼烧后含有少量铜其原因可能是灼热不充分,铜未被完全氧化,也可能是灼烧过程中部分氧化铜被还原。


(3)利用途径Ⅱ制取胆矾时,必须先加酸将氧化铜溶解,加热通氧气将Cu氧化,过滤除去粗制氧化铜中的不溶物杂质后,然后再蒸发溶剂,冷却结晶,再过滤得晶体,最后将其干燥,由此可写出答案。
(4)根据途径Ⅰ的反应方程式Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O和途径Ⅱ的反应方程式2Cu+O2+2H2SO4(稀)
CuSO4+SO2↑+2H2O和途径Ⅱ的反应方程式2Cu+O2+2H2SO4(稀) ?2CuSO4+2H2O,可以看出途径Ⅱ的优点是:①产生等量的胆矾比途径Ⅰ耗硫酸少;②途径Ⅱ不产生污染大气的气体(SO2)。
?2CuSO4+2H2O,可以看出途径Ⅱ的优点是:①产生等量的胆矾比途径Ⅰ耗硫酸少;②途径Ⅱ不产生污染大气的气体(SO2)。
(5)称量操作至少进行4次,分别是:①称量坩埚;②称量加入晶体后的坩埚;③称量加热冷却后的坩埚;
④称量再加热、再冷却后的坩埚至两次称量的值相差不超过0.1 g。
(6)若测定结果x值偏高,可能是加热温度过高使CuSO4晶体中的CuSO4分解了,其他三项均使x值偏低。
本题难度:一般