1、选择题 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是(?)
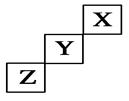
A.X、Y、Z三种元素中,X的非金属性最强
B.Y氢化物的稳定性比Z的氢化物弱
C.Y的最高正化合价为+7价
D.X单质的熔点比Z的低
参考答案:D
本题解析:由题目信息(短周期图示位置关系),可确定X、Y、Z三种元素分别为He、F、S。A项中,非金属性最强的是F;B项中,HF比H2S更稳定;C项中,元素F无正化合价;D项中,因常温常压下He为气体,S为固体,故D正确。
本题难度:一般
2、选择题 以下对核外电子运动状况的描述正确的是(?)
A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
B.能量低的电子只能在s轨道上运动,能量高的电子总在f轨道上运动
C.在同一原子里能找到两个能量相同的电子
D.在同一电子亚层上运动的电子,其运动状态肯定相同
参考答案:C
本题解析:略
本题难度:一般
3、推断题 下表为元素周期表的一部分,请参照元素在表中的位置,回答下列问题(凡能用化学用语的必须用相应的化学用语回答):
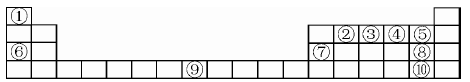
(1)用原子符号表示中子数为8的编号为③的原子____,以上元素中原子的电子层数等于最外层电子数的元素为____,⑤、⑥、⑦、⑧三元素的简单离子半径由大到小的顺序为?。
(2)②①④三种元素能按原子个数比1:2:1形成一种在室内装修过程中常见的气体污染物。该气体分子的中心原子的杂化轨道类型为____,1mol该分子中π键的数目为____。
(3)写出⑥的单质在④的单质中燃烧产生的化合物的电子式?,该化合物与足量⑨的低价硫酸盐溶液反应的离子方程式?。
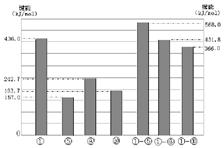
(4)同主族元素的单质及化合物在许多性质上都存在着递变规律。下图是①、⑤、⑧、⑩的单质及①分别和⑤、⑧、⑩形成的化合物的键能大小。
由图中键能数据推断得知:①—R键(R表示⑤、⑧、⑩)的键能随分子中键长的增长而?(填“增大”或“减小”)。同主族元素随着原子序数的递增,非金属元素的单质分子中化学键的键长逐渐增大,键能____(填“一定减小”或“不一定减小”)根据图中键能数据,写出①的气态单质在⑧的气态单质中燃烧的热化学方程式____。
参考答案:(14分)
(1)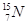 ? (1分);H、Al? (2分) ;? Cl->F-> Na+ > Al3+? (1分)
? (1分);H、Al? (2分) ;? Cl->F-> Na+ > Al3+? (1分)
(2)SP2? (1分)? NA (1分)
(3)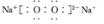 (2分);
(2分);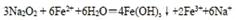 (2分)
(2分)
(4)减小(1分);不一定减小(1分)
本题解析:
结合题中周期表可推出:①H ;②C; ③N; ④O ;⑤F ;⑥Na ;⑦Al ;⑧Cl ;⑨Fe ;⑩Br。
(1)中子数为8的N的原子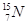 ;电子层数等于最外层电子数的元素为H、Al;Cl-有三个电子层,F- 、Na+、Al3+有二个电子层,电子层结构相同,序数越大半径越小。
;电子层数等于最外层电子数的元素为H、Al;Cl-有三个电子层,F- 、Na+、Al3+有二个电子层,电子层结构相同,序数越大半径越小。
(2)原子个数比1:2:1形成一种在室内装修过程中常见的气体污染物为甲醛(CH2O), C是SP2杂化;1个CH2O分子中有一个π键,
(3)Na单质在O2中燃烧产生的化合物:Na2O2。
(4)由图中键能数据推断得知结论。
本题难度:一般
4、选择题 下列有关金属元素特征的叙述正确的是
A.金属元素的原子只有还原性,其阳离子只有氧化性
B.金属元素的单质在常温下都为固态
C.金属元素在不同化合物中化合价均不相同
D.金属元素在化合物中一定显正价
参考答案:D
本题解析:A、金属单质在反应中只能失去电子,但处于中间价态的金属离子既有氧化性又有还原性,如亚铁离子既有氧化性又有还原性,故A错误;
B、因金属单质Hg在常温下为液体,故B错误;
C、因绝大数金属元素只有一种正价,则在不同化合物中化合价相同,故C错误;
D、因金属元素在反应中失去电子,则化合价一定升高,所以金属元素在化合物中一定显正价,故D正确。
故选D。
点评:本题考查金属元素的性质,熟悉常见的金属单质及金属对应的阳离子是解答本题的关键,难度不大。
本题难度:一般
5、选择题 已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,A在反应中既不容易得电子也不容易失电子,元素B的最外层电子数是电子层数的3倍,元素D与A为同族元素,元素C和E形成的化合物CE是海水中的主要成分。下列说法不正确的是
A.离子半径:r(E)>r(B)>r(C)
B.熔点:CE>DE4
C.C与B形成的两种化合物中化学键类型不同
D.A、D、E的最高价氧化物对应水化物的酸性逐渐增强
参考答案:D
本题解析: A在反应中既不容易得电子也不容易失电子,因此A是第ⅣA族元素,元素D与A为同族元素,所以根据原子序数A小于D可知,A应该是碳元素,则D是硅元素。元素B的最外层电子数是电子层数的3倍,原子序数大于碳元素而小于硅元素,则B是氧元素。元素C和E形成的化合物CE是海水中的主要成分,因此C是钠元素,E是氯元素。A、离子的核外电子层数越多,离子半径越大。核外电子排布相同的微粒离子半径随原子序数的增大而减小,因此离子半径:r(E)>r(B)>r(C),A正确;B、氯化钠形成的晶体是离子晶体,四氯化硅形成的晶体是分子晶体,因此熔点CE>DE4,B正确;C、C与B形成的两种化合物是氧化钠和过氧化钠,前者含有离子键,后者含有离子键和非极性键,中化学键类型不同,C正确;D、非金属性越强,最高价氧化物对应水化物的酸性逐渐增强,非金属是Cl>C>Si,所以D、A、E的最高价氧化物对应水化物的酸性逐渐增强,D不正确,答案选D。
本题难度:一般