1、填空题 (10分)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是?,向其中加入少量KOH溶液时,发生反应的离子方程式是?
(2)现将0.04mol·L-1HA溶液和0.02mol·L-1NaOH溶液等体积混合,得到缓冲溶液。①若HA为HCN,该溶液显碱性,则溶液中c(Na+)?c(CN-)(填“<”、“=”或“>”),你得出该结论的依据是?
②若HA为CH3COOH,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是
?
参考答案:(10分)
(1)A-+H+=HA(2分);HA+OH-=H2O+A-(2分)
(2)①>(2分)?因为c(Na+)+c(H+)=c(CN-)+c(OH-),溶液显碱性,则c(H+)<c(OH-),所以c(Na+)>c(CN-)(2分)
②c(CH3COO-)>c(Na+)>c(H+)>c(OH-)或CH3COO-、Na+、H+、OH-(2分)
本题解析:弱酸HA和其钠盐NaA的混合溶液,用作缓冲溶液,说明HA与碱反应,NaA可以与酸反应,使溶液在遇到酸碱后pH变化不会太大。
(1)加入少量盐酸时,强酸会生成弱酸HA,离子方程式A-+H+=HA;加入强碱氢氧化钾时,会发生酸碱中和反应,HA+OH-=H2O+A-。
(2)0.04mol·L-1HA溶液和0.02mol·L-1NaOH溶液等体积混合,得到0.01mol·L-1HA溶液和0.01mol·L-1NaA溶液:①显碱性,则盐的水解大于酸的电离,则c(Na+)>c(CN-),可以根据溶液中电荷守恒进行推断,c(Na+)+c(H+)=c(CN-)+c(OH-),因为c(H+)<c(OH-),所以c(Na+)>c(CN-)。②若HA显酸性,则电离大于水解,则c(CH3COO-)>c(Na+)>c(H+)>c(OH-),也可以根据溶液中电荷守恒计算。
点评:离子浓度的大小比较是高中学习的难点,是本题的一个难点。
本题难度:一般
2、选择题 下列各组离子在给定条件下,一定能大量共存的是?(?)
A.含有大量NO—3的水溶液中:NH+4、Fe2+、SO2-4、H+
B.在pH=12的溶液中:ClO—、SO2-3、Na+、K+
C.能与铝粉反应生成氢气的溶液中:Na+、Al3+、CH3COOO—、I—
D.含有大量HCO—3的澄清透明溶液中:K+、C6H5O—、Cr—、Na+
参考答案:D
本题解析:A不能,因为其中有H+,硝酸根离子在氢离子存在的情况下表现出强氧化性,可将亚铁离子氧化成铁离子。
B不能,次氯酸根离子有强氧化性,可以将亚硫酸根离子氧化。
C不能,能与铝粉反应生成氢气的溶液可能是酸溶液,也可能是碱溶液,在酸中CH3COOO—不能大量存在,在碱中Al3+不能大量存在。
D正确,可以大量共存。
本题难度:一般
3、选择题 在加入铝粉能放出H2的溶液中,一定能大量共存的离子组是( )
A.K+、Na+、CO32-、SO42-
B.NH4+、Na+、Cl-、HCO3-
C.K+、Na+、Cl-、SO42-
D.K+、Na+、OH-、SO42-
参考答案:A.如溶液呈酸性,则CO32-不能大量存在,故A错误;
B.无论溶液呈酸性还是碱性,HCO3-都不能大量存在,故B错误;
C.无论溶液呈酸性还是碱性,离子之间不发生任何反应,可大量共存,故C正确;
D.在酸性条件下OH-不能大量存在,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 已知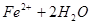

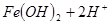 ,则往浅绿色的
,则往浅绿色的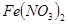 溶液中逐滴加入稀盐酸,溶液颜色的变化情况是
溶液中逐滴加入稀盐酸,溶液颜色的变化情况是
A.变为深绿色
B.变为黄棕色
C.褪为无色
D.没有颜色变化
参考答案:B
本题解析:因为在酸性条件下,NO3-能氧化Fe2+,生成Fe3+,所以溶液颜色会变成棕黄色,答案选B。
本题难度:简单
5、选择题 实验室配制一种仅含四种离子(不包括水电离的离子)的无色混合溶液,且要求混合溶液中四种离子的浓度均相等,下列选项能达到要求的是( )
A.Cu2+、NH4+、SO42-、NO3-
B.Ca2+、Al3+、NO3-、Cl-
C.Na+、Mg2+、SO42-、I-
D.H+、HCO3-、K+、F-
参考答案:A.Cu2+有颜色,如溶液无色不符,故A错误;
B.溶液无色,但四种离子的浓度均相等时,溶液电荷不守恒,故B错误;
C.溶液无色,四种离子的浓度均相等时,溶液电荷守恒,且离子之间不发生任何反应,能共存,故C正确;
D.H+与HCO3-、F-不能大量共存,不能达到实验要求,故D错误.
本题解析:
本题难度:简单