1、选择题 下列说法正确的是(?)
A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(Cl-)>c(NH4+)
C.0.1 mol/L的氯化铵溶液与0.05 mol/L的氢氧化钠溶液等体积混合,溶液中离子浓度c(Cl-)>c(NH4+)>c(Na+)>c(OH-)
D.0.1 mol·L-1硫化钠溶液中离子浓度关系c(OH-)=c(H+)+c(HS-)+c(H2S)
参考答案:C
本题解析:A.如在CH3COONa溶液中,存在水解平衡:CH3COO-+H2O CH3COOH+OH-。醋酸根离子水解消耗水电离产生的H+,促进了水的电离,当最终达到平衡时c(OH-)>c(H+).所以溶液显碱性。在此溶液中存在一定数量的CH3COOH。错误。B.根据电荷守恒可得c(OH-)+c(Cl-)=c(NH4+)+c(H+)。由于溶液显中性,所以c(OH-)=c(H+),两式相减可得c(Cl-)=c(NH4+)。错误。C.假设溶液的体积都为1L.0.1 mol/L的氯化铵溶液与0.05 mol/L的氢氧化钠溶液等体积混合时,则n(Cl-)="0.1mol;" n(Na+)="0.05" mol.发生反应:NH4Cl+NaOH=NaCl+NH3·H2O反应后n(NH4Cl)=n(NaCl)=n(NH3·H2O)=" 0.05" mol.既存在NH4+的水解作用,也存在NH3·H2O的电离作用。NH4+水解使溶液显酸性,NH3·H2O电离使溶液显碱性。由于NH3·H2O电离作用大于NH4+水解作用,所以n(NH4+)>0.05 mol,n(NH3·H2O)< 0.05 mol.c(OH-)>c(H+).在同一溶液中离子的物质的量越多,离子的浓度就越大。强电解质的电离作用大于弱电解质的电离,所以n(Na+)>c(OH-)。因此在该溶液中各种离子的浓度大小关系为c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)。正确。D.硫化钠是强碱弱酸盐,水解使溶液下碱性,在0.1 mol/L硫化钠溶液中根据质子守恒可得c(OH-)=c(H+)+c(HS-)+2c(H2S).错误。
CH3COOH+OH-。醋酸根离子水解消耗水电离产生的H+,促进了水的电离,当最终达到平衡时c(OH-)>c(H+).所以溶液显碱性。在此溶液中存在一定数量的CH3COOH。错误。B.根据电荷守恒可得c(OH-)+c(Cl-)=c(NH4+)+c(H+)。由于溶液显中性,所以c(OH-)=c(H+),两式相减可得c(Cl-)=c(NH4+)。错误。C.假设溶液的体积都为1L.0.1 mol/L的氯化铵溶液与0.05 mol/L的氢氧化钠溶液等体积混合时,则n(Cl-)="0.1mol;" n(Na+)="0.05" mol.发生反应:NH4Cl+NaOH=NaCl+NH3·H2O反应后n(NH4Cl)=n(NaCl)=n(NH3·H2O)=" 0.05" mol.既存在NH4+的水解作用,也存在NH3·H2O的电离作用。NH4+水解使溶液显酸性,NH3·H2O电离使溶液显碱性。由于NH3·H2O电离作用大于NH4+水解作用,所以n(NH4+)>0.05 mol,n(NH3·H2O)< 0.05 mol.c(OH-)>c(H+).在同一溶液中离子的物质的量越多,离子的浓度就越大。强电解质的电离作用大于弱电解质的电离,所以n(Na+)>c(OH-)。因此在该溶液中各种离子的浓度大小关系为c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)。正确。D.硫化钠是强碱弱酸盐,水解使溶液下碱性,在0.1 mol/L硫化钠溶液中根据质子守恒可得c(OH-)=c(H+)+c(HS-)+2c(H2S).错误。
本题难度:一般
2、选择题 在强酸性溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO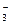 、MnO
、MnO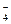
B.Mg2+、Na+、Cl-、SO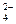
C.K+、Na十、Br-、Cu2+
D.Na十、Ba2+、OH-、SO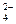
参考答案:B
本题解析:略
本题难度:一般
3、选择题 下列各组离子在对应溶液中可能大量存在的是
A.水电离出的c(H+)=10-12mol·L-1的溶液:K+、Cu2+、SO32-、MnO4-
B.与铝粉反应能放出氢气的溶液:Na+、SO42-、HCO3-、Cl-
C.含有大量ClO-的溶液:H+、I-、SO42-、Cl-
D.pH=12的溶液:K+、Cl-、SO32-、SiO32-