| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《离子共存》在线测试(2017年最新版)(八)
参考答案:C 本题解析:A、四种离子不能大量共存,因为溶液中含有氯气、亚铁离子,酸性条件下,氯气与亚铁离子发生氧化还原反应,不能大量共存,错误;B、通入二氧化碳后,硅酸根离子与二氧化碳反应生成硅酸沉淀,不能大量共存,错误;C、四种离子都不反应,且通入二氧化碳后也不反应,可以大量共存,正确;D、一水合氨与银离子生成银氨离子不能大量共存,错误,答案选C。 本题难度:一般 2、选择题 下列反应的离子方程式正确的是 电解 C.以石墨作电极电解氯化镁溶液:2Cl-+2H2O ="==" 2OH-+H2↑+Cl2↑ D.碳酸氢钠溶液加入氯化铝溶液 3HCO3-+Al3+ 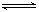 3CO2+Al(OH)3 3CO2+Al(OH)3参考答案:B 本题解析:略 本题难度:一般 3、选择题 某钠盐溶液中可能含有NO2-、SO42-、SO32-、CO32-、Cl-、NO3-等阴离子。某同学取5份此溶液样品,分别进行了如下实验: 参考答案:A 本题解析:A、①用pH计测得溶液pH大于7,说明溶液呈碱性;②加入盐酸,产生有色刺激性气体,由于要放出有色刺激性气体,所以可以是亚硝酸的自身分解,反应的方程式为:2HNO2=H2O+NO↑+NO2↑,或是NO3-与SO32-之间发生氧化还原反应,因此不能说明溶液中含有NO2-,不正确;B、③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体,说明溶液中含有Cl-;④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色,说明溶液含有CO32-,没有SO42-、SO32-,因此一定含有NO2-,B正确;C、⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色,说明溶液中含有具有氧化性的离子NO2-、或NO3-,因此根据以上分析可知不能确定是否一定含有NO3-,C正确;D、由④即可确定一定不存在SO42-、SO32-,D正确,答案选A。 本题难度:一般 4、选择题 下列各组离子在给定条件下一定能大量共存的是 参考答案:C 本题解析:A、水电离出的c(H+)=1×10-14 mol?L?1,可能为酸性溶液,也可能为碱性溶液,[Ag(NH3)2]+与OH?反应,不能大量共存,错误;B、Al3+与HCO3?的水解反应相互促进,不能大量共存,错误;C、c(H+)=1×10-13 mol·L-1的溶液,含有大量OH?,各离子互不反应,可以大量共存;D、NO3?、H+氧化Fe2+,不能大量共存。 本题难度:一般 5、选择题 在水电离出的C(H+)=10-14mol/L的溶液中,一定能大量共存的离子组是( ) |
参考答案:C
本题解析:
【错解分析】选B、C。因为溶液中水电离出的C(H+)=10-14 mol/L所以C(OH-)="1" mol/L为强碱溶液 ,故B也正确 。 因不能掌握水电离的影响因素而错选B。
【正解】判断溶液中离子能否共存的规律归纳起来就一句话:一色、二性、三特殊、四反应。这些内容在复习时都以强调我就不多说了。另外,判断离子共存问题应看清前置条件,如“在强酸性溶液中”“在无色透明溶液中”“因发生氧化还原反应”等等,再分析离子间相互反应情况。
溶液中由水电离出的C(H+)=10-14 mol/L,是一种类型题,等效于Al与该溶液反应放出氢气。实际上由水电离出的C(H+)=10-14 mol/L,是水的电离受到了抑制,情况是加酸或加碱都可以造成水的电离受到了抑制,因此B选项中AlO2-在酸性条件下不能大量共存,故该题选项正确的只有C(注意另条件可能)。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《电解质溶液.. | |