1、选择题 下列关于碱金属元素的叙述中正确的是(?)
A.钾比钠更活泼,在反应中更易失去电子,作氧化剂
B.钠比铜活泼,将钠投入CuSO4溶液中有单质铜析出,并产生少量气体
C.钠的熔点较低,其熔点低于水的沸点
D.钠的密度较小,其密度比煤油小
参考答案:C
本题解析:钠很活泼,钠与溶液接触时,先与水剧烈作用产生大量氢气;钠与水作用时浮游于水面,并熔化成小球,说明密度比水小,但比煤油大。
本题难度:简单
2、选择题 将NH4HCO3置于干的试管中加热,并使放出的气体依次通过盛有足量过氧化钠和碱石灰的干燥管,最后得到的气体有(?)?
A.NH3、O2
B.H2O、O2
C.CO2、O2
D.O2
参考答案:A
本题解析:NH4HCO3受热分解的的产物是氨气、CO2和水蒸气,先通过盛有足量过氧化钠的干燥管,CO2和水蒸气被吸收,同时生成氧气。再通过盛有足量碱石灰的干燥管,氨气和氧气不能被吸收,所以最终的气体就是氨气和氧气。答案A。
本题难度:一般
3、实验题 (12分)NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。
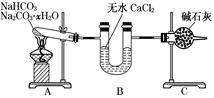
(1)A装置的作用是____________________________。
(2)B装置的作用是____________________________。
(3)C装置的作用是____________________________。
(4)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,则x的值为??。
(5)该装置还不是很完善,可能使测定结果偏小,应如何改进________。为什么?
参考答案:(1)加热,使NaHCO3分解,使Na2CO3·xH2O失水
(2)吸收反应中生成的水 (3)吸收反应中生成的CO2
(4)10
(5)在C装置后再加一个装有碱石灰的U形管
为了防止空气中的CO2和H2O被C装置中的碱石灰吸收
本题解析:从该实验的目的和要求来看:(1)A装置的作用是加热,使NaHCO3分解,使Na2CO3·xH2O失水。(2)B装置的作用是吸收反应中生成的水。(3)C装置的作用是吸收反应中生成的CO2。
(4)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,从A,B,C,的作用可以看到:A的试管中装入NaHCO3和Na2CO3·xH2O的混合物总质量3.7 g,B管增重1.89 g,包括NaHCO3分解产生的水,和Na2CO3·xH2O失去的水,C管增重0.22 g,仅仅是碳酸氢钠分解产生的二氧化碳,由定量关系可知:2NaHCO3=Na2CO3+H2O +CO2↑ ,碳酸氢钠分解产生的二氧化和水的物质的量是相同的。所以计算关系如下:
2NaHCO3?= ?Na2CO3?+? H2O?+? CO2↑
168? 1? 18? 44
Z=0.84g? Y="0.09" g? 0.22 g
所以Na2CO3·xH2O的质量是3.7 g-0.84g=2.86g?,
所以Na2CO3·xH2O中的水的质量是1.89g-0.09g=1.8g
所以x的值为10。
(5)该装置还不是很完善,可能使测定结果偏小,应在C装置后再加一个装有碱石灰的U形管
为了防止空气中的CO2和H2O被C装置中的碱石灰吸收。
点评:熟悉碳酸氢钠和碳酸钠的性质此类问题不难解决。
碳酸氢钠的化学性质
1.与酸反应
与HCl反应:NaHCO?+HCl ="===" NaCl+ H?O+ CO?↑
与CH?COOH反应:NaHCO?+CH?COOH====CH?COONa+H?O+CO?↑
2.与碱反应
与氢氧化钠反应:NaHCO?+NaOH="===" Na2CO?+ H2O
与氢氧化钙反应:要分过量和少量。
少量:NaHCO?+ Ca(OH)?="===" CaCO?+ NaOH + H?O过量:2NaHCO?+ Ca(OH)?="===" Na2CO?+ CaCO?↓+ 2H?O
3.加热
受热分解:2NaHCO?==△="=" Na?CO?+ H?O + CO?↑
4.电离
碳酸氢钠电离方程式 NaHCO?="Na+" + HCO3﹣。
碳酸钠的化学性质
1 风化
碳酸钠的结晶水合物石碱(Na2CO3·10H2O)在干燥的空气中易风化。
Na2CO3·10H2O====Na2CO3+10H2O
2 与酸反应
Na2CO3+ 2HCl(过量) ="===" 2NaCl +H2CO3
碳酸不稳定,分解成二氧化碳和水
H2CO3====H2O + CO2↑
Na2CO3+ HCl(少量) ="===" NaCl + NaHCO3
3 与碱反应
Na2CO3+ Ca(OH)2="===" 2NaOH + CaCO3↓(碳酸钙白色沉淀,难溶于水,但可溶于酸)
4 与盐反应
Na2CO3+ BaCl2="===" 2NaCl + BaCO3↓(碳酸钡白色沉淀,难溶于水,但可溶于酸)
3Na2CO3+ Al2(SO4)3+ 3H2O ="===" 2Al(OH)3↓+ 3Na2SO4+ 3CO2↑
(氢氧化铝白色沉淀,难溶于水,可溶于酸、碱)
Na2CO3+CaCl2=====2NaCl+CaCO3↓
5 与H2O、CO2反应
Na2CO3+ H2O + CO2="===" 2NaHCO3(于碱性环境中沉淀析出)
本题难度:一般
4、选择题 有8gNa2O2、Na2O、Na2CO3、NaOH的混合溶液与200g质量分数为3.65%的盐酸恰好完全反应,蒸干溶液,最终得固体质量为
A.8g
B.15.5g
C.11.7g
D.无法计算
参考答案:C
本题解析:
正确答案:C
根据原子守恒:Cl原子全留在NaCl中,m(NaCl)=200g×3.65%÷36.5g·mol-1×58.5g·mol-1=11.7g
本题难度:一般
5、选择题 有一白色固体粉末可能是碳酸钠、亚硫酸钠、硫酸钠中的一种或二种,某兴趣小组拟对该样品进行探究。
(1)取少量样品溶解于水。溶解所用的玻璃仪器有?;
测定溶液的pH,若测得溶液的pH=7,则样品中一定含有?,
(2)如果要检验该样品是否含有硫酸钠,某人的方法如下:取少量(1)的溶液加?
?;(写出试剂、现象、结论)
(3)取适量固体样品加入过量盐酸中,有气体放出。若要检验放出气体的组成,从以下限定试剂中选择合适的试剂设计一个组合实验分析该混合气体的组成,简要写出实验方案、现象和结论。
限定试剂:品红溶液、澄清石灰水、酸性KMnO4溶液、氢氧化钠浓溶液、饱和NaHCO3溶液。
实验方案
| 可能的现象和相应的结论
|
将混合气体依次通过盛有?、?、?__的洗气瓶。
| ?
|
?
参考答案:(16分)
(1)烧杯、玻璃棒(2分,各1分);?硫酸钠 (1分);?
(2)足量的盐酸(1分),充分反应后(或无明显现象)再加少量的BaCl2溶液(1分),若有沉淀出现说明样品中有Na2SO4(1分),若无沉淀,则说明说明样品中没有Na2SO4(1分)。 (共4分)
注意:无量说明扣1分,加Ba(NO3)2不扣分。
(3)(共9分)
实验方案
可能的现象和相应的结论
品红溶液、
(足量)酸性KMnO4溶液、(足量)澄清石灰水
(3分,各1分)
若品红褪色,酸性KMnO4溶液不完全褪色(或不褪色),澄清石灰水变浑浊,(1分)该气体是SO2、CO2的混合气体(1分);
若品红褪色,酸性KMnO4溶液不完全褪色(或不褪色),澄清石灰水不变浑浊,(1分)该气体是SO2(1分);
若品红不褪色,酸性KMnO4溶液不褪色,澄清石灰水变浑浊,(1分)该气体是CO2(1分);
本题解析:
(1)溶解所用的玻璃仪器有:烧杯、玻璃棒;碳酸钠和亚硫酸的溶液中,因为弱离子水解导致溶液显示碱性,只有硫酸钠是不水解的盐,显中性,故答案为:硫酸钠;
(2)要检验该样品是否含有硫酸钠,只需检验其中的硫酸根离子即可,根据硫酸根离子的特征离子反应:能和钡离子反应生成不溶于盐酸的白色沉淀来进行,注意不能用硝酸,硝酸具有氧化性,能将亚硫酸根离子氧化,
故答案为:取适量固体样品加入过量盐酸中,然后加入BaCl2溶液,若有沉淀出现说明样品中有Na2SO4,若无沉淀,则说明说明样品中没有Na2SO4;
(3)取适量固体样品加入过量盐酸中,有气体放出,该气体是二氧化碳和二氧化硫中的至少一种,二氧化硫和二氧化碳均能使澄清石灰水变浑浊,在检验二氧化碳之前先检验二氧化硫的存在并将二氧化硫除净,最后用澄清石灰水来检验二氧化碳,二氧化硫的检验使用品红,除去二氧化硫可以用高锰酸钾,二氧化碳的检验用澄清石灰水,故答案为:
实验方案
可能的现象和相应的结论
品红溶液、
(足量)酸性KMnO4溶液、(足量)澄清石灰水
(3分,各1分)
若品红褪色,酸性KMnO4溶液不完全褪色(或不褪色),澄清石灰水变浑浊,(1分)该气体是SO2、CO2的混合气体(1分);
若品红褪色,酸性KMnO4溶液不完全褪色(或不褪色),澄清石灰水不变浑浊,(1分)该气体是SO2(1分);
若品红不褪色,酸性KMnO4溶液不褪色,澄清石灰水变浑浊,(1分)该气体是CO2(1分);
本题难度:简单