1、选择题 将4 mol A 气体和2 mol B 气体在2 L的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g)  ?2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是
?2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是
①用物质A表示的反应的平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③反应达到平衡时,A、B、C的反应速率一定相等
④反应达到平衡时,A、B、C的物质的量均不再变化
A、①③? B、①④? C、②③? D、③④
参考答案:B
本题解析:考查可逆反应大有关计算,一般采用三段式,即
2A(g)+B(g)  ?2C(g)
?2C(g)
起始量(mol)? 4? 2? 0
转化量(mol)?1.2? 0.6? 1.2
平衡量(mol)? 2.8? 1.4? 1.2
所以用物质A表示的反应的平均速率为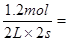 ? 0.3 mol/(L·s)
? 0.3 mol/(L·s)
用物质B表示的反应的平均速率为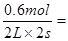 ? 0.6 mol/(L·s)
? 0.6 mol/(L·s)
平衡时正逆反应速率相等,各种物质大浓度不再发生变化。但各种物质的反应速率不一定相等,所以正确的答案是B。
本题难度:一般
2、填空题 (12分)向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应
SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
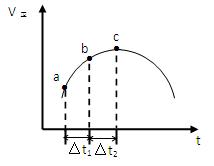
(1)点a-c段,速率变化的主要原因是?,点c后速率变化的主要原因是?。
(2)c点是否已经达到平衡状态?(填“是”、“否”或“不一定”)
(3)反应物浓度:a点?b点(填“<”、“=”或“>”)
(4)反应物的总能量?生成物的总能量(填“<”、“=”或“>”)
(5)△t1=△t2时,SO2物质的量的变化量:a~b段?b~c段(填“<”、“=”或“>”)
参考答案:(每空2分)(1)反应放热,温度升高,反应速率加快;反应物浓度减小,反应速率减慢。(2)否(3)>? (4)>? (5)<
本题解析:略
本题难度:一般
3、填空题 在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系: Cr2O72- + H2O  ?2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
?2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈____色,因为?。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈?色, 因为?。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡?,溶液颜色将?。
参考答案:(每空2分,共12分)?⑴黄; 中和H+平衡向正反应方向移动
⑵橙红色; 增加生成物浓度平衡向逆反应方向移动?⑶正反应方向移动; 变浅
本题解析:(1)加入少量NaOH固体后,中和溶液中的氢离子,导致氢离子浓度降低,平衡向右移动,所以溶液呈黄色。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则增加生成物浓度平衡向逆反应方向移动,Cr2O72-浓度增大,溶液呈橙红色。
(3)向原溶液中加入Ba(NO3)2溶液,生成BaCrO4沉淀,CrO42-浓度降低,平衡正向移动,溶液的颜色变浅。
点评:该题是基础性试题的考查,难度不大。试题紧扣教材,针对性强,主要是考查学生灵活运用勒夏特例原理解决实际问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。
本题难度:一般
4、选择题 在密闭容中发生下列反应aA(g)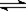 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 (? )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 (? )
A.A的转化率变大
B.平衡向正反应方向移动
C.D的体积分数变大
D.a < c+d
参考答案:D
本题解析:将气体体积压缩到原来的一半瞬间D的浓度是用来的2倍,但达到平衡时,D的浓度为原平衡的1.8倍,说明增大压强平衡向逆反应方向移动,因此a < c+d,所以正确的答案选D。
本题难度:简单
5、选择题 在一密闭容器中有如下反应:aX(g)+bY(g) nW(g);ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
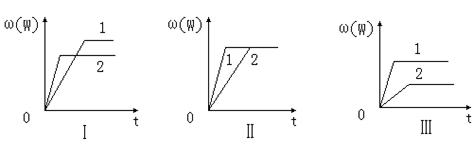
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间。当其它条件不变时,下列分析正确的是
A.图Ⅰ可能是不同压强对反应的影响,且p2>p1,a+b<n
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b
C.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0
参考答案:AC
本题解析:对于A来说,当a+b<n时,增大压强,平衡向左移动,所以ω(W)减少,并且压强增大,反应速率就变大,所以表现在图上就是斜率较大,故A正确,B错误;对于催化剂并不能改变平衡的移动方向,但是可以缩小达到平衡所需要的时间,对于图Ⅱ来说,1达到平衡所需要的时间较短,所以催化效果好,故C也正确;对于D来说,温度升高,反应速率加快,同时对于ΔH<0来说,温度高ω(W)较小,即D错误,应该改为ΔH>0。
点评:该题考查化学平衡的移动,是高考的考查重点,该题的信息量较大,有一定的难度。
本题难度:一般