1、选择题 将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)?NH3(g)+HI(g);②2HI(g)?H2(g)+I2(g)达到平衡时,c(H2)=0.5mol?L-1,c(HI)=4mol?L-1,则此温度下反应①的平衡常数为( )
A.9
B.16
C.20
D.25
2、填空题 .(16分)Ⅰ.已知下列反应的热化学方程式为:
(1) C(s) + O2(g) = CO2(g)?△H1 =" -393.5" kJ/mol
(2) CH3COOH(l) + 2O2(g) = 2CO2(g) + 2H2O(l)?△H2 =" -870.3" kJ/mol
(3) 2H2(g) + O2(g) = 2H2O(l)?△H3 =" -571.6" kJ/mol
请计算:2C(s) + 2H2(g) + O2(g)= CH3COOH(l)?△H4 = ?。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2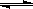 2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1L)。反应在前10min内的平均速率为ν(t-BuNO)=?。列式计算上述反应的平衡常数K = ? 。
(2)有关反应:(t-BuNO)2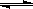 2(t-BuNO) 的叙述正确的是(?)
2(t-BuNO) 的叙述正确的是(?)
A.压强越大,反应物的转化率越大? B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。
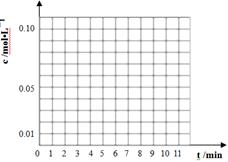
时间(min)
| 0
| 1
| 3
| 5
| 7
| 9
| 11
|
c(t-BuNO)2 mol/L
| 0.05
| 0.03
| 0.01
| 0.005
| 0.003
| 0.002
| 0.002
|
c(t-BuNO) mol/L
| 0
| 0.04
| 0.08
| 0.07
| 0.094
| 0.096
| 0.096
|
Ⅲ.甲醇燃料电池的电解质溶液是KOH溶液。则通甲醇的电极反应式为?。若通空气的电极上有32g O2参加反应,则反应过程中转移了?mol e-。
3、选择题 在2L的密闭容器里充入4molN2和6molH2,在一定条件下使其反应,5min后测得反应混合物中NH3占25%(体积分数),则此时用氮气表示反应速率为
[? ]
A.0.05mol/L·min
B.0.1mol/L·min
C.0.125mol/L·min
D.0.25mol/L·min
4、填空题 下图表示800℃时,A、B、C三种气体物质的浓度随时间t变化的情况。试回答:
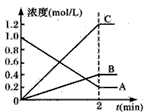
(1)该反应的反应物是____。
(2)该反应的化学方程式为___。
(3)2min内,A物质的平均反应速率为____。
5、填空题 汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为?
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是?%(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应? (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 ?.
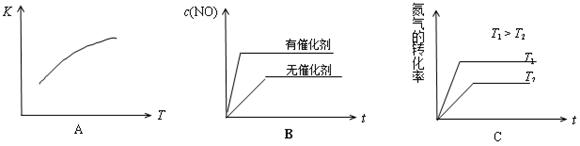
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 ?(填字母序号)。
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数?(填“变大、“变小”或“不变)