1、选择题 下列氧化还原反应中,同一元素既被氧化又被还原的是(?)
A.2NO+O2====2NO2
B.N2+O2====2NO
C.N2+3H2====2NH3
D.3NO2+H2O====2HNO3+NO
参考答案:D
本题解析:同一元素既被氧化又被还原,表现为这种元素的化合价既升高又降低,标出化合价即可判定。
本题难度:简单
2、实验题 (8分)某科研小组,用含有少量的CaO和Fe2O3的高岭土(主要成分:Al2O3·2SiO2·2H2O)来研制新型净水剂,其实验方案如下:将土样和纯碱混合均匀,加热熔融,冷却后用水浸取熔块,过滤弃去残渣,滤液用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液即是净水剂。
(1)土样和纯碱混合均匀,加热熔融时,土样中的主要成分与纯碱反应的化学方程式为:
①?;②Al2O3+Na2CO3 2NaAlO2+CO2↑。
2NaAlO2+CO2↑。
(提示:NaAlO2易溶于水并转化为Na[Al (OH)4])
(2)最后得到的沉淀物是?,生成沉淀的离子方程式为?。
(3)实验室中常备的坩埚有瓷坩埚,氧化铝坩埚和铁坩埚,本实验熔融土样时应选用?坩埚。
参考答案:(1)SiO2+Na2CO3 Na2SiO3+CO2↑(2)H4SiO4;2H++SiO32-+H2O=H4SiO4↓(3)铁
Na2SiO3+CO2↑(2)H4SiO4;2H++SiO32-+H2O=H4SiO4↓(3)铁
本题解析:这是一道信息给予题,根据题示情境分析:(1)高岭土熔化时,其成分中的SiO2和Al2O3与Na2CO3反应生成Na2SiO3和NaAlO2。(2)熔块加水使Na2SiO3和NaAlO2溶解与其他杂质分离,在过滤后的滤液中加入盐酸则使Na2SiO3、Na[Al (OH)4]分别与过量的盐酸反应,生成H4SiO4沉淀和AlCl3溶液,过滤得滤液即为净水剂。(3)因为瓷坩埚中含有SiO2,氧化铝坩埚主要成分是Al2O3,它们都能与Na2CO3在高温下发生反应,故熔融样品时只能用铁坩埚。
本题难度:简单
3、选择题 下列试剂的保存方法,错误的是(?)
A.把浓HNO3放在棕色试剂瓶中,并置于冷暗处保存
B.把AgNO3放在棕色试剂瓶中保存
C.把NaOH溶液放在带橡皮塞的玻璃瓶中
D.把氢氟酸放在玻璃瓶中,把白磷保存在煤油中
参考答案:D
本题解析:由于HF可与玻璃中的成分SiO2作用生成SiF4气体,故D选项不正确。
本题难度:简单
4、实验题 (16)某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO。其实验流程图如下:

(1)测定硝酸的物质的量
反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如右上图所示。在B容器中生成硝酸的物质的量为?mol。
(2)测定NO的体积
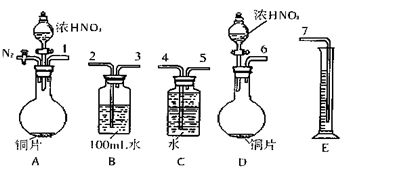
①从上图所示的装置中,你认为应选用?装置进行Cu与浓硝酸反应实验,选用的理由是?。
②选用上图所示仪器组合一套可用来完成实验并测定生成NO体积的装置,其合理的连接顺序是(填各导管口编号)?。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置
?(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析:若实验测得NO的体积为112.0mL(已折算到标准状况),则Cu与浓硝酸反应的过程中?(填“有”或“没有”)NO产生,作此判断的依据是?。
(4)实验前,用托盘天平称取的铜片至少应为??g。
参考答案:(1)0.008(2分)
(2)A(2分,因为A装置可以通N2装装置中的空气排尽,防止反应生成的NO被装置内空气中O2氧化(2分)
②123547(2分,若只填出“1547”给1分)?③升高(2分)
(3)有(2分)
因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6mL<112.0mL)(2分)
(4)0.5(2分)
本题解析:(1)NaOH+HNO3=NaNO3+H2O
1? 1
则:c(NaOH)V(NaOH)=n(HNO3),带入数据,得:
n(HNO3)=4×0.1mol·L-1×(20.40-0.40)×10-3L=0.008mol
(2) ②A中生成的气体可能有NO、NO2,通过B(3 NO2+H2O=2HNO3+NO)将NO2转化为NO,再通过C排水到E中,E中测得水的体积即为NO体积;
③若量筒中水的液面比集气瓶的液面要低,说明装置内气压小于外界气压,所以应将量筒的位置升高,以保证量筒中的液面与集气瓶中的液面持平;
(3)3 NO2+H2O=2HNO3+NO,由(1)知:n(HNO3)= 0.008mol
2? 1
0.008mol 0.004mol
V(NO)= 0.004mol×22.4mol.L-1=89.6mL
即:NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6mL<112.0mL)
(4) (4)由(3),得:n(NO2)=0.012mol,
反应中生成的n(NO)=(0.112-0.0896)L/22.4L·mol-1=0.001mol
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O? 3Cu+8HNO3(浓)=3Cu(NO3)2+2NO↑+4H2O
1? 2? 3? 2
0.006mol?0.012mol? 0.0015mol? 0.001mol
则n(Cu)= 0.006mol +0.0015mol="0.0075" mol,
所以:m(Cu)=" 0.0075" mol×64g·mol-1=0.48g,≈0.5g
本题难度:一般
5、选择题 将5.6 g的Mg?Cu混合物完全溶解于足量的硝酸中,收集反应产生的气体X。再向所得溶液中加入过量的NaOH溶液,产生10.7g沉淀。根据题意推断气体X的成分可能是
A.0.05 mol NO、0.15 mol NO2
B.0.2 mol NO2
C.0.15 mol NO
D.0.05 mol NO、0.1mol NO2、0.05 mol N2O4
参考答案:A
本题解析:略
本题难度:一般