1、填空题 实验室用图I所示的装置制取干燥的氨气。

(1)A处反应的化学方程式为?。
(2)为收集到干燥的氨气,导管C应接?(填序号)。
(3)装置B中盛装的试剂的名称是?。
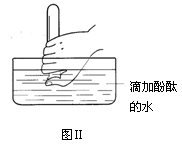
(4)在水槽中加入水(含酚酞),将充满氨气的试管倒置于放入水槽中(如图Ⅱ所示),将拇指稍移开试管口,可观察到的现象为_______________?。
(5)在D、E、F三种气体收集方法中,能用于收集NO的是________(填写序号)。
参考答案:(1)2NH4Cl + Ca(OH)2 2NH3 ↑+ 2H2O + CaCl2?(2)E(3)碱石灰(生石灰或固体氢氧化钠)
2NH3 ↑+ 2H2O + CaCl2?(2)E(3)碱石灰(生石灰或固体氢氧化钠)
(4)溶液进入试管中,无色溶液变红 (5)D
本题解析:(1)A为氨气的发生装置,实验室利用氯化铵和氢氧化钙在加热条件下制取氨气,化学方程式为2NH4Cl + Ca(OH)2 2NH3 ↑+ 2H2O + CaCl2;(2)氨气极易溶于水,不能用排水法收集,氨气的密度比空气小,应用向下排空气法收集,为收集到干燥的氨气,导管C应接E;(3)装置B的作用是干燥氨气,盛装的试剂的名称是碱石灰(生石灰或固体氢氧化钠);(4)氨气极易溶于水,与水反应生成弱碱一水合氨;可观察到的现象为溶液进入试管中,无色溶液变红;(5)NO能与空气中的氧气反应,不能用排空气法收集,一氧化氮不溶于水,可用排水法收集,在D、E、F三种气体收集方法中,能用于收集NO的是D。
2NH3 ↑+ 2H2O + CaCl2;(2)氨气极易溶于水,不能用排水法收集,氨气的密度比空气小,应用向下排空气法收集,为收集到干燥的氨气,导管C应接E;(3)装置B的作用是干燥氨气,盛装的试剂的名称是碱石灰(生石灰或固体氢氧化钠);(4)氨气极易溶于水,与水反应生成弱碱一水合氨;可观察到的现象为溶液进入试管中,无色溶液变红;(5)NO能与空气中的氧气反应,不能用排空气法收集,一氧化氮不溶于水,可用排水法收集,在D、E、F三种气体收集方法中,能用于收集NO的是D。
本题难度:一般
2、选择题 铜和镁的合金4.7克完全溶于浓硝酸中,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已经折算成标准状况)。在反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为
A.9.02g
B.8.26g
C.8.61g
D.7.04g
参考答案:C
本题解析:根据题意最终生成的沉淀是氢氧化铜和氢氧化镁,由于金属失去电子的物质的量就是金属阳离子结合的OH-的物质的量。NO2和N2O4分别是0.2mol和0.015mol,所以反应中转移电子是0.2mol+0.015mol×2=0.23mol,则结合的OH-的质量是0.23mol×17g/mol=3.91g,所以沉淀的质量是3.91g+4.7g=8.61g,答案选C。
本题难度:一般
3、实验题 (12分)(1)实验室常用氯化铵固体跟氢氧化钙粉末混合加热制取氨气,该反应的化 学方程式为?;
学方程式为?;
(2)实验室制取氨气时应用的发生装置是下图中的?(填标号),收集装置是
?(填标号),选用该收集装置而不用图中另外两个收集装置的原因是?。
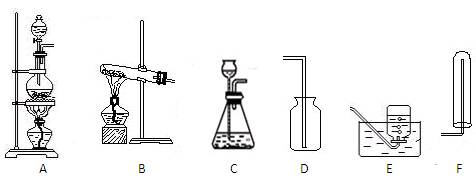
(3)实验室可用C装置制取的气体是?(任答一种),该反应的化学方程式为?。
参考答案:
本题解析:略
本题难度:一般
4、选择题 如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是

[? ]
实验现象
解释
A.
浓盐酸附近产生白烟?
NH3与浓盐酸反应产生了NH4Cl固体
B.
浓硫酸附近无明显现象
NH3与浓硫酸不发生反应
C.
氯化物溶液变浑浊
?该溶液一定是AlCl3溶液
D.
干燥红石蕊试纸不变色,湿润红石蕊试纸变蓝
NH3是一种可溶性碱
参考答案:A
本题解析:
本题难度:一般
5、选择题 在常温常压下,下列各种气体不能大量共存的是
A.O2与SO2
B.NO2和NO
C.O2与N2
D.NO与O2
参考答案:D
本题解析:A?O2与SO2在加热和有催化剂的情况下才反应,在常温常压下能共存。
B 在常温常压下,NO2和NO不反应。
C? O2与N2在放电的时候才反应。
D? NO与O2在常温情况下反应生成NO2,常温下不能共存。
本题难度:一般