1、填空题 (1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用下图所示的工艺流程生产硫酸:
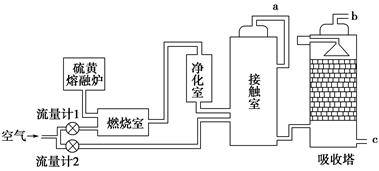
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装________(填设备名称)。吸收塔中填充有许多瓷管,其作用是___________________________________。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为________(空气中氧气的体积分数按0.2计),该尾气的处理方法是________。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是________(可多选)。
A.耗氧量减少? B.二氧化硫的转化率提高
C.产生的废渣减少? D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面________(可多选)。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式________________________。
参考答案:(1)①热交换器 增加SO3与浓硫酸的接触面积,有利于SO3的吸收 ②1.2 0.004 用氨水吸收 ③A、C
(2)B、C、D
(3)CaCO3 CaO+CO2↑;2SO2+2CaO+O2
CaO+CO2↑;2SO2+2CaO+O2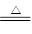 2CaSO4(或2SO2+2CaCO3+O2
2CaSO4(或2SO2+2CaCO3+O2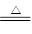 2CaSO4+2CO2)
2CaSO4+2CO2)
本题解析:(1)①接触室中进行的反应为SO2的催化氧化,为放热反应,使用热交换器可以充分利用反应放出的热量,对原料气进行预热。吸收塔中填充瓷管的作用是增加接触面积。
②S+O2=SO2参加反应的硫黄为1 mol,则经流量计1通入的氧气为1.5 mol,反应后气体总量为1.5 mol×5=7.5 mol,
2SO2 +O2? ?2SO3 ΔV
?2SO3 ΔV
2 ?1 ?2 ?1
1 mol 0.5 mol
经流量计2通入的氧气为0.5 mol×2.5=1.25 mol,则? =1.2。反应后气体总量为7.5 mol+1.25 mol×5-1 mol×95%×
=1.2。反应后气体总量为7.5 mol+1.25 mol×5-1 mol×95%×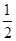 ?=13.275 mol,则尾气中SO2的体积分数为
?=13.275 mol,则尾气中SO2的体积分数为 =0.004。
=0.004。
硫酸工业中,尾气SO2用氨水吸收,再用硫酸处理:SO2+2NH3+H2O=(NH4)2SO3,(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O。生成的(NH4)2SO4可作肥料。
③硫铁矿的含硫成分为FeS2,硫元素被氧化生成SO2的同时,铁元素也被氧化生成Fe2O3(废渣),与硫黄直接燃烧相比,耗氧量增加,产生的废渣也增加。
(2)橡胶的硫化是采用硫黄;合成烷基苯磺酸钠需要先合成烷基苯磺酸,而烷基苯磺酸通过烷基苯与浓硫酸的磺化反应生成;铅蓄电池用硫酸作为电解质溶液;过磷酸钙通过磷酸钙与硫酸反应制得。
(3)CaCO3 ?CaO+CO2↑
?CaO+CO2↑
SO2+CaO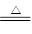 ?CaSO3
?CaSO3
2CaSO3+O2=2CaSO4
CaSO3不稳定,在空气中容易被氧化成CaSO4。
本题难度:一般
2、实验题 工业上采用硫化钠-石灰铁盐法处理高砷废水(砷的主要存在形式为H3AsO3)取得了很好的效果。实现了废水处理过程的“三废”零排放。其主要工艺流程如下:
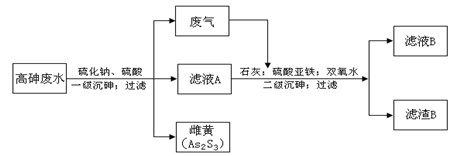
已知:①亚砷酸(H3AsO3)还原性较强,易被氧化为砷酸(H3AsO4)
②亚砷酸盐的溶解性大于相应的砷酸盐[如Ksp(FeAsO3)>Ksp(FeAsO4)]
请回答以下问题:
(1)废气的主要成分为?,通过与石灰发生?反应(填基本反应 类型)被吸收。
类型)被吸收。
(2)写出一级沉砷过程中生成雌黄的离子方程式:?。
(3)滤液A中,除了有Na2SO4、H2SO4以外,还有溶质?。
(4)二级沉砷过程中使用双氧水的目的有?。
A.将三价砷氧化为五价砷,以提高除砷效果
B.将Fe2+氧化可生成Fe(OH) 3沉淀,以加速悬浮物的沉降
C.作绿色氧化剂,不引进新的杂质
(5)过滤操作常用的玻璃仪器有:?
(6)滤渣B的主要成分有?(写两种,用化学式表示)。
参考答案:(10分)(每空2分)
(1)H2S;中和反应(或复分解反应) 2分
(2)2H3AsO3+3S2-+6H+→As2S3↓+6H2O
(或 2H3AsO3+3S2-→As2S3↓+6OH-;H++OH-→H2O)(2分)
(3)H3AsO3(2分)
(4)A B C(少1个选项扣1分,直至扣完)(2分)
(5)漏斗、烧杯、玻璃棒(2分)
(6)FeAsO4 、Ca3(AsO4)2 、Ca3(AsO3)2、Fe(OH) 3 、CaSO4等(合理答案均给2分)
本题解析:略
本题难度:一般
3、选择题 化学与环境保护密切相关。下列叙述中正确的是
[? ]
A.处理废水时加入明矾可作为消毒剂以除去水中的杂质
B.垃圾是放错地方的资源,应分类回收利用
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.为提高农作物的产量和质量,应大量使用化肥和农药
参考答案:B
本题解析:
本题难度:简单
4、填空题 (11分)电解法制烧碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下:
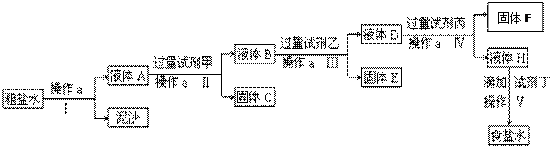
请回答以下问题:
(1)操作a的名称是____________。
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的沉淀,则试剂甲为________溶液。试剂乙为?,固体F为?。
(3)在第Ⅴ步中,加入试剂丁直到溶液无明显变化时,写出此过程的化学方程式?、?_?。
参考答案:(1)过滤(1分)(2)NaOH、BaCl2、CaCO3和BaCO3(每空2分)(3)NaOH + HCl =" NaCl" + H2O? Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑(每空2分)
本题解析:略
本题难度:简单
5、填空题 已知:N2(g)+3H2(g) 2NH3(g)? ΔH<0;2SO2(g)+O2(g)
2NH3(g)? ΔH<0;2SO2(g)+O2(g) 2SO3(g)? ΔH<0;
2SO3(g)? ΔH<0;
回答下列问题:
(1)从影响速率和平衡的因素分析,要有利于NH3和SO3的生成,理论上应采取的措施是_________________。实际生产中采取的措施分别是__________________。
(2)在实际生产的合成氨过程中,要分离出氨气,目的是____________________________;而合成SO3过程中,不需要分离出SO3,原因是__________________。
参考答案:(1)高温、高压、催化剂?合成氨:高温、高压、催化剂;合成SO3:高温、常压、催化剂?(2)减少生成物浓度,使平衡向生成NH3方向移动?该反应向生成SO3的方向进行程度大,达到平衡后SO2余量较少,故不需要分离SO3
本题解析:根据两个反应的特点:合成氨与二氧化硫的反应均是体积减小、放热的气体反应。所以从提高反应速率和增大反应物转化率来看:选择高温、高压、催化剂的条件均是合理的。但实际上,还要考虑设备的耐压能力、经济技术条件等因素,经过综合分析才能确定生产条件。
本题难度:简单