1、选择题 为检验Na2SO3溶液中是否含有Na2SO4应选用的试剂是
A.BaCl2溶液
B.BaCl2溶液、稀盐酸
C.BaCl2溶液、稀硝酸
D.BaCl2溶液、稀硫酸
参考答案:B
本题解析:亚硫酸钠和硫酸钠都能和氯化钡反应生成白色沉淀,但亚硫酸钡能和盐酸反应,生成SO2、氯化钡和水,所以B正确,A、D不正确。由于硝酸具有氧化性,能被亚硫酸钠氧化生成硫酸钠,所以C不正确,答案选B。
本题难度:简单
2、填空题 海洋是个巨大的资源宝库,利用海水可制取许多化工产品。
(1)氯碱工业是以电解食盐水为基础化学工业,写出电解食盐水的化学方程式___________________________________________________________________.
(2)从海水中提取溴常用吹出法,即用氯气(Cl2)将海水里溴化钠(NaBr)中的溴置换出来,再用空气吹出溴(Br2)。流程示意图如下:
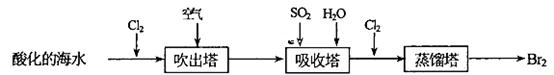
①写出氯气从NaBr中置换出溴单质的化学方程式:____________________;该反应在pH=3的酸性条件下进行,可用________测定反应液的酸碱度。
②吹出的溴和大量空气混合在—起进入吸收塔,根据流程图分析,通入SO2和水的目的是。_____________________________________________________.(用化学方程式表示)
参考答案:(1) 2NaCl+2H2O Cl2↑+H2 ↑+2NaOH
Cl2↑+H2 ↑+2NaOH
(2)①Cl2+2NaBr=2NaCl+Br2?PH试纸
②Br2+S02+2H20═H2S04+2HBr
本题解析:
(1) 2NaCl+2H2O Cl2↑+H2 ↑+2NaOH
Cl2↑+H2 ↑+2NaOH
(2)①依据题干叙述可知氯气和溴化钠可以置换出溴单质,反应物是氯气和溴化钠,生成物是氯化钠和溴,根据观察法配平即可,其化学方程式为:Cl2+2NaBr=2NaCl+Br2,常见的测定溶液酸碱度的方法是使用pH试纸测定溶液的酸碱度。
②由于吸收塔中发生的反应是Br2+S02+2H20═H2S04+2HBr所以加入二氧化硫的目的是使溴与空气相互分离;
本题难度:一般
3、选择题 下列实验方案不合理的是? ( )

A.制硫酸和氢氧化钠:可用如图所示装置
B.除去粗盐中的Ca2+、Mg2+、SO42—;依次加入的物质是H2O、Ba(OH)2、Na2CO3、HCl
C.检验Fe(NO3)2试样是否变质:取少量试样加水溶解,用稀硫酸酸化,滴加KSCN溶液
D.乙醛的氧化 :在试管里加入10%的NaOH溶液2 mL,滴入2%的CuSO4溶液4~6滴,振荡后加入乙醛溶液0.5 mL,加热至沸腾
参考答案:C
本题解析:A项,阳极区氢氧根放电生成氧气,H+浓度增大.SO42—在通过阴离子交换膜在阳极区富集,故阳极区生成硫酸,同理,阴极区有氢氧化钠生成,bc两膜中间可不断补充硫酸钠溶液。B项,粗盐加水溶解后,加Ba(OH)2除去SO42—,加Na2CO3除去Ca2+、Mg2+和过量的Ba2+,最后加HCl除去过量的CO32—。C项,Fe(NO3)2中加稀硫酸酸化,H+与NO结合形成稀硝酸环境,具有强氧化性,能将Fe2+氧化为Fe3+,滴加KSCN溶液后显红色,无法判定原试样是否变质。D项,保证了NaOH溶液足量,可发生乙醛与新制氢氧化铜悬浊液的反应。
本题难度:一般
4、选择题 下列说法中正确的是
A.1mol·L-1的NaCl溶液是指此溶液中含有1molNaCl
B.从1L0.5mol·L-1的NaCl溶液中取出100mL溶液,其物质的量浓度变为0.1mol·L-1
C.0℃时,1molCl2的体积约为22.4L
D.1mol·L-1的CaCl2溶液中,Cl-的物质的量浓度为2mol·L-1
参考答案:D
本题解析:A不正确,应该是指1L溶液中含有1 mol NaCl。溶液是均一、稳定的,所以B中取出的溶液浓度仍然是0.5mol/L的,B不正确。在标准状况下,1mol氯气的体积是22.4L,C不正确。氯化钙中阴离子和阳离子的个数之比是1︰2,D正确。答案选D。
本题难度:一般
5、选择题 三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3。选择一种试剂把它们区别开,该试剂是(?)
A.盐酸
B.氢氧化钠溶液
C.氯化钡溶液
D.硝酸
参考答案:A
本题解析:略
本题难度:简单