将CO2通入Na2SiO3溶液中
参考答案:D
本题解析:A、二氧化碳、二氧化硫都与碳酸钠溶液反应,不符合除杂的原则,错误;B、Cu与CuO都与硝酸反应,不符合除杂的原则,错误;C、检验溶液中是否含有亚铁离子,应先加入KSCN溶液,溶液不变红,再向溶液中滴加氯水,溶液变红色,说明溶液中存在亚铁离子,直接加入氯水,不能判断原溶液中含有亚铁离子,错误;D、将CO2通入Na2SiO3溶液中,若出现白色沉淀,证明碳酸酸性比硅酸酸性强,正确,答案选D。
本题难度:一般
2、填空题 (6分)有两包白色粉末,只知分别是K2CO3和NaHCO3,请你写出鉴别方法(写出3种方法可得6分,3种以上方法得7分)
(1)?。?
(2)?。
(3)?。
?。
参考答案:(6分) (1) 加热分解法:取两种少许待检粉末于试管中,分别加热,有CO2气体产生的是NaHCO3。
(2)盐酸产气法:取两种少许待检粉末于试管中,同时分别在两支试管中加入1mL稀盐酸,产气速度快的是NaHCO3。
(3)焰色反应法:取两种粉末进行焰色反应实验,透过钴玻璃能够观察到紫色火焰的是K2CO3。
本题解析:考查物质的检验,本质是考查相关物质性质的不同
(1)K2CO3和NaHCO3的金属阳离子不同,可通过焰色反应进行检验;
(2)K2CO3和NaHCO3中,后者的热稳定性差,加热可分解并且生成CO2气体,而前者的热稳定性好,加热不分解
(3)K2CO3和NaHCO3虽均可与盐酸反应,但后者与酸反应速率快
(4)向两物质的溶液中加入氯化钡溶液,有白色沉淀生成的为K2CO3
本题难度:简单
3、选择题 关于纸层析法分离铁离子和铜离子的实验,下列说法正确的是
A.采用滤纸作固定相,用9ml丙酮与lmL 6mol·L-1盐酸配成的混合溶液作展开剂
B.应沿试管壁小心将展开剂慢慢倒入试管底部
C.层析时样点浸入展开剂中
D.配制试样溶液浓度较大,点样时试样斑点较小
参考答案:D
本题解析:略
本题难度:简单
4、简答题 某化学兴趣小组设计了如下实验方法来分离NaCl和CaCl2两种固体混合物
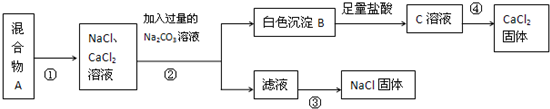
根据上述实验方法回答下列问题:
(1)请指出步骤③所用的操作是:______.
(2)在上述①②③的操作中都用到了一种仪器,此仪器是______.
(3)步骤②中发生反应的离子方程式是:______.物质B→C转变过程中发生反应的离子方程式为______.
(4)用此实验方法分离得到的NaCl固体经分析还含有杂质,所含杂质是(填化学式):______为了除去这种杂质可以向过滤得到的滤液中加入适量的______.
参考答案:循环转化图的含义是:现将混合物加水溶解形成水溶液,再向氯化钠和氯化钙的水溶液中加入碳酸钠,就会和氯化钙反应生成碳酸钙和氯化钠,碳酸钙能和盐酸反应生成氯化钙,碳酸铵和盐酸反应生成氯化钠,每次所加试剂均过量.
(1)根据转化图,步骤③处理的滤液主要成分是氯化钠,从氯化钠溶液中获得氯化钠晶体可以采用蒸发(结晶)的方法,故答案为:蒸发(结晶);
(2)上述①②③的操作分别是:溶解、过滤、蒸发,都要用到的仪器是玻璃棒,故答案为:玻璃棒;
(3)步骤②中,向氯化钙和氯化钠的混合液中加碳酸钠,会和其中的氯化钙发生复分解反应,发生反应的离子方程式是:Ca2++CO32-=CaCO3↓,碳酸钙溶于盐酸的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故答案为:Ca2++CO32-=CaCO3↓;CaCO3+2H+=Ca2++CO2↑+H2O;
(4)步骤②后所得的滤液成分主要是生成的氯化钠和剩余的碳酸钠,可以加盐酸将碳酸钠反应掉,故答案为:Na2CO3;稀盐酸.
本题解析:
本题难度:一般
5、选择题 某盐溶液中离子的浓度为:c(Na+)=0.2 mol/L,c(Mg2+)=0.4 mol/L,c(Cl-)=0.4 mol/L和未知浓度的SO42-,则SO42-的`物质的量浓度为
A.0.1 mol/L
B.0.3 mol/L
C.0.5 mol/L
D.0.15 mol/L
参考答案:B
本题解析:由于该混合物中共含有四种微粒,根据溶液呈电中性,四者所带的正负电荷总数应相等,所以:n(Na+)+2n(Mg2+)=n(Cl-)+2n(SO42-),即0.2 mol/L+2×0.4 mol/L=0.4 mol/L+2×c(SO42-),解得c(SO42-)=0.3 mol/L.
本题难度:一般
|