1、选择题 己知:Cu+2Fe3+=2Fe2++Cu2+。现把相同物质的量的CuSO4、FeCl3和Zn置于水中充分反应,反应器中所得混合物除含有SO2-4和Cl-外,还含有
A.Zn2+、Cu、Fe3+
B.Zn、Cu2+、Fe3+
C.Zn2+、Cu2+、Fe、Fe2+
D.Zn2+、Cu、Cu2+、Fe2+
参考答案:D
本题解析:略
本题难度:简单
2、选择题 已知酸性条件下有如下反应:2Cu+ Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
加入
试剂
| 稀硫酸
| 浓硫酸、
加热
| 稀硝酸
| 浓硝酸
|
实验
现象
| 红色固体和
蓝色溶液
| 无色气体
| 无色气体和
蓝色溶液
| 红棕色气体
和蓝色溶液
|
由此推出本次氢气还原氧化铜实验的产物是( )
A.Cu?B.一定有Cu,可能有Cu2O
C.Cu2O? D.一定有Cu2O,可能有Cu
参考答案:D
本题解析:由红色固体与稀硫酸反应的实验现象知该红色固体中一定含有Cu2O,又由于Cu2O、Cu分别与浓硫酸、稀硝酸、浓硝酸反应时产生的现象分别相同,故无法确定红色固体中是否有Cu。
本题难度:一般
3、选择题 下列叙述正确的是(?)
A.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
B.向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色
C.向一定体积的热浓硫酸中加入过量的铁粉,生成的气体能被烧碱溶液完全吸收
D.将SO2气体通入溴水,欲检验溶液中是否有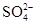 生成,可向溶液中滴加Ba(NO3)2溶液
生成,可向溶液中滴加Ba(NO3)2溶液
参考答案:B
本题解析:A项,FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl;B项,由于还原性I->Fe2+,所以向FeI2溶液中通入少量Cl2,Cl2首先与I-反应:Cl2+2I-=I2+2Cl-;C项,过量的Fe与热浓硫酸反应,首先产生SO2气体,随着反应的进行,浓硫酸的浓度逐渐变稀,后来稀硫酸与Fe反应产生H2;D项,由于发生反应:SO2+Br2+2H2O=H2SO4+2HBr,欲检验溶液中的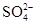 ,应向溶液中加入BaCl2溶液,若加入Ba(NO3)2溶液,则不能排除
,应向溶液中加入BaCl2溶液,若加入Ba(NO3)2溶液,则不能排除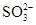 的干扰,故选B项。
的干扰,故选B项。
本题难度:一般
4、填空题
(1)写出Cu制取CuSO4(稀H2SO4环境下)的方程式________________;
(2)Cu与浓H2SO4共热也能制取CuSO4,其反应方程式为:________________;以上两种制取方法________________者好(填“前”或“后”),原因是________________。
参考答案:(1)2H2SO4+O2+2Cu 2CuSO4+2H2O
2CuSO4+2H2O
(2)2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O?前?节省硫酸用量,无污染物排放
CuSO4+SO2↑+2H2O?前?节省硫酸用量,无污染物排放
本题解析:在加热条件下,Cu与O2作用转变为CuO,CuO可溶于稀H2SO4生成CuSO4和H2O。
本题难度:简单
5、选择题 有关物质的转化关系如下图所示(部分物质和条件已省去),C、X均是单质,H溶液呈浅绿色,I溶液呈棕黄色。下列有关判断正确的是

A. X固体可能是碘单质
B. 图中所示反应均为氧化还原反应
C. 1mol C与E溶液完全反应转移电子数为NA(NA为阿伏加德罗常数)
D. E、H、I溶液配制时,均需加酸防止其水解
参考答案:B
本题解析:H溶液呈浅绿色含亚铁离子,I溶液呈棕黄色含Fe3+,X固体为还原剂,而碘单质无法将Fe3+还原为Fe2+,故A错误;C气体为强氧化性气体,1mol C与H溶液完全反应转移电子数不一定为NA,若为氯气则为2NA,故C错误;E可能为稀的强酸溶液如盐酸,则无需防止其水解,D错误;图中所示H、I溶液的转化反应为氧化还原反应,E转化为H需加还原剂X,也是氧化还原反应,答案选B。
本题难度:一般